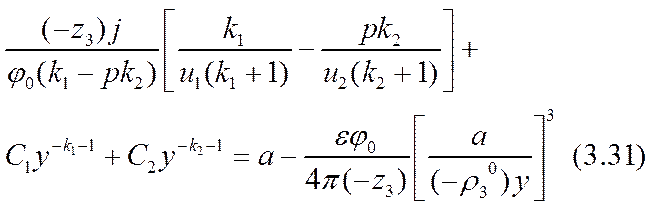
Это уравнение получено в результате использования приближенного значения функции r3 (х) по формуле (3.26). Поэтому оно само есть уравнение приближенное. Эту приближенность можно использовать для определения констант интегрирования С1 и С2, а также масштабного параметра а, усилив «предельное» неравенство (3.26) при соблюдении для r1 (х) и r2 (х) условий (3.14)
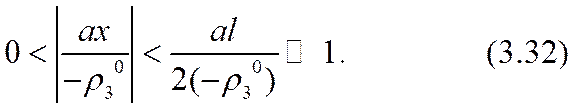
Здесь равенство al = 2 (- r03 ) соответствовало бы достижению «предельного» тока. Усиление (3.32) неравенства (3.26) позволяет обеспечить справедливость точного (а не асимптотического, как в формуле (2.51)) разложения уравнения (3.31) по степеням малого параметра a º a x /(- r03 ) , |a|<<1. Для определения трех параметров: С1, С2 и а достаточно использовать первые три члена этого разложения. Коэффициенты уравнения при нулевой, первой и второй степенях разложения окажутся:
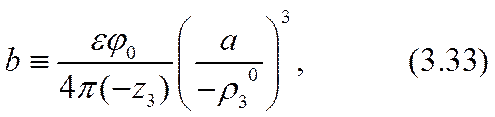
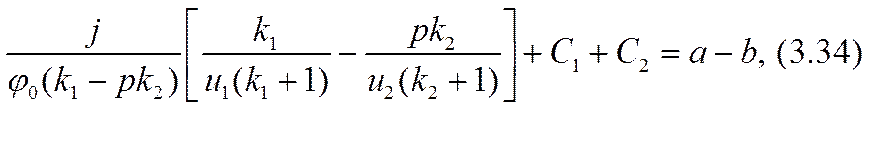
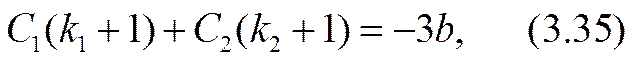
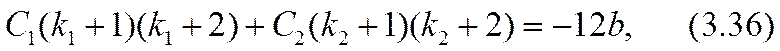
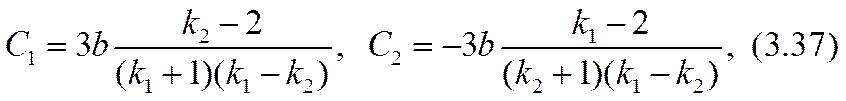
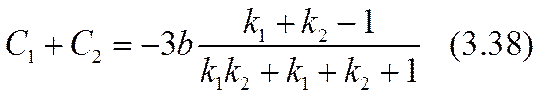
Разрешив эту систему уравнений относительно констант интегрирования и малого масштабного параметра а, можно завершить расчетную задачу в нулевом приближении.
Здесь достаточно ограничиться определением параметра а в достигнутом приближении. Для этого нужно исключить из трех уравнений константы интегрирования С1 и С2 и составить одно (кубическое) уравнение для параметра а:
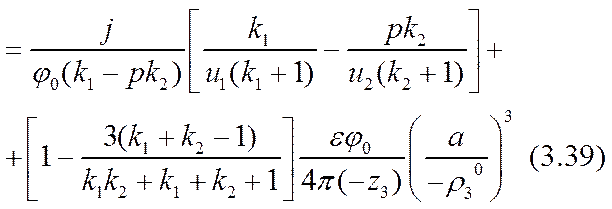
В рамках избранного нулевого (по отступлению от линейности соотношения (3.26), а не по отступлению от электронейтральности!) приближения все условия аналитической задачи соблюдены точно, кроме закона сохранения вещества ионов активных компонент по формуле (3.22). В этом нулевом приближении в замыкающем уравнении (3.31) остались неиспользованные члены со степенями малого параметра а (см. (3.32)) выше второй. Для повышения точности необходимо в линейной формуле (3.29) учесть более высокие степени этой малой дроби и подставить полученный результат в уравнение (3.31).
Важнейший результат этого математического анализа явлений в окислительно-восстановительных электрохимических системах состоит в обнаружении в нулевом приближении корректной применимости приближения Планка — точно такой же линейной зависимости плотности распределения пассивной компоненты от координаты r3 = r3 (х), как это было установлено для бинарных систем в гл. 2 (формула (2.47)) в первом приближении по отступлению от электронейтральности. Поэтому та же самая цепь равенств (2.52) и (2.80), которая в том случае связывала все функции с координатой, оказывается справедливой и для тернарных систем. В этой цепи важнейшими для физики ЭГД явлений функциями являются объемные заряды ri ( x), пондеромоторные силы f (х) и созданные ими давления р (х). Что касается следующих приближений, то пока нет оснований утверждать что-либо определенное ввиду большей сложности явлений в тернарных системах — большого числа необходимых для анализа параметров — по сравнению с бинарными. Было бы полезно продолжить такие исследования и в отношении тернарных и особенно четверных систем.
В работе [3.10] дан пример расчета зависимости важнейших электрохимических функций от координаты х для смеси водных растворов иодидов калия при нейтральных электродах в режиме прохождения постоянного тока. Расчет выполнен в приближении линейпого распределения плотности объемного заряда пассивной компоненты К +. Пример соответствует плоскопараллельной ячейке с межэлектродным расстоянием l = 3.2 мм = 3.2• 10-3 м и площадью каждого электрода 2.56-10-5 м2. Ячейка заполнена водным раствором моноиодида калия в концентрации 0,05 н, в котором добавочно растворен кристаллический иод в концентрации 0,005 н. Здесь символ «н» означает «нормальность» раствора в г-экв/л. Через ячейку проходит постоянный ток плотностью 7.5-10-8 А/см2 = 0,75 А/м2 при комнатной температуре 18 °С. Расчет проведен в безразмерных переменных:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.