Е=4,7*10-3*kT*exp{-0,116nkT+0,0093(n+5,05)/kT }, (6)
E=1,095 10-4 exp{0,0046 kT + 0,00154 (n+86,5)/ kT}. (7)
 Здесь
к-постоянная Больцмана, Т-абсолютная температура, n-число атомов
углерода в молекуле СnH2n+2.
Здесь
к-постоянная Больцмана, Т-абсолютная температура, n-число атомов
углерода в молекуле СnH2n+2.
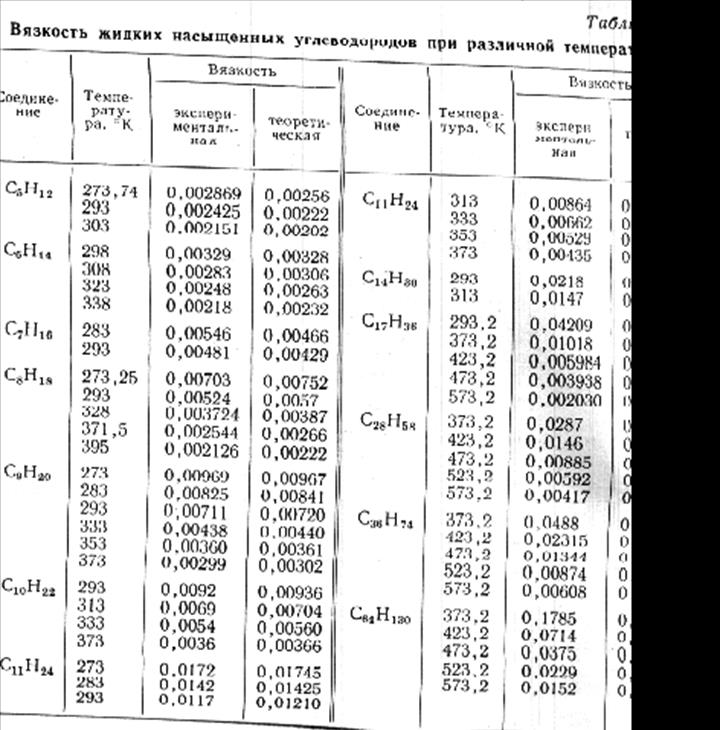
В таблице 1 приведены значения вязкости вычисленные по формулам 6 и 7, и приведенные в справочной литературе для насыщенных углеводородов. Расхождения не превыщают 5-10%.
Формулы 6 и 7 по своей структуре соответствуют известным выражениям
E=BT exp W1 /kT , (8)
E=A exp W2 /kT , (9)
Здесь АиВ постоянные, W1 и W2 -энергия активации, соответствующая явлению вязкости. Как известно из статистической физики физический смысл постоянных А иВ заключается в следующем
А-1, ВТ-1 пропорциональны числу столкновений молекул при данной температуре, а сомножитель exp W1 /kT пропорционален вероятности столкновений молекул. Численная величина сомножителя exp W1 /kT очень мала, например при энергии активации в 20 ккал/моль при комнатной температуре она равна 10-15.
В формулах Адамчевского 6 и 7, энергия активации по порядку ниже и соответствует 1-2 ккал/моль.
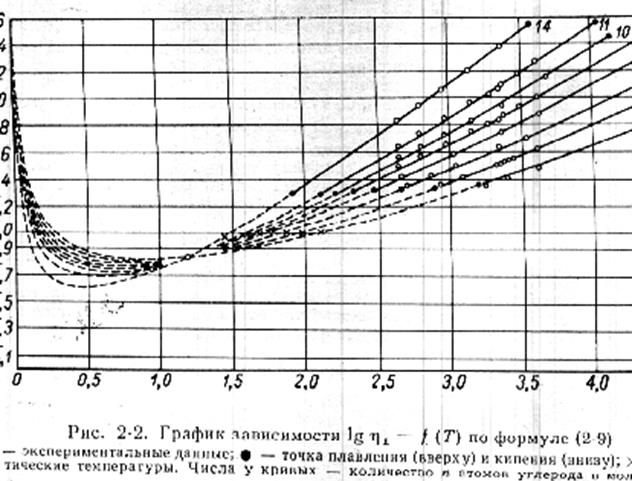 Как
видно из сравнения формул 6 и 7 с формулами 8 и 9 механизм вязкости изменяется
при переходе к углеводородам с числом атомов углерода выше 28.
Как
видно из сравнения формул 6 и 7 с формулами 8 и 9 механизм вязкости изменяется
при переходе к углеводородам с числом атомов углерода выше 28.
Ни одна из теорий вязкости жидкости в настоящее время не является универсальной, значения предсказанные теорией иногда отличаются от измеренных на несколько порядков.
Как известно теория жидкости наталкивается на большие трудности, в особенности для жидкостей с многоатомными молекулами. Однако в некоторых случаях удалось вывести зависимости свойств жидкости от структуры молекул, исходя из полуэмпирических соображений, или из законов термодинамики или статфизики. С точки зрения электрофизики жидкости эти зависимости позволяют установить взаимосвязь некоторых электрофизических свойств жидкости, таких как проводимость, коэффициенты диссоциации и рекомбинации молекул, их подвижности, а также величины пробивных напряжений с молекулярной структурой. Длина молекулы парафин. углеводорода h=h0+a(n-1),
 Рассмотрим
некоторые результаты, касающиеся группы насыщенных углеводородов. Например в
работах Курата и Исиды получены следующие соотношения для температуры кипения Тk
для углеводородов типа Сn H2n+2.
Рассмотрим
некоторые результаты, касающиеся группы насыщенных углеводородов. Например в
работах Курата и Исиды получены следующие соотношения для температуры кипения Тk
для углеводородов типа Сn H2n+2.
Тk=(0,00057+0,00775/n2/3)-1. (1)
Здесь n-характеризует число молекул водорода в молекуле углеводорода. Формула достаточно хорошо описывает экспериментальные данные. У Адамчевского приведены полуэмпирические формулы описывающие зависимость температуры кипения и плавления Тпл. для парафиновых углеводородов.
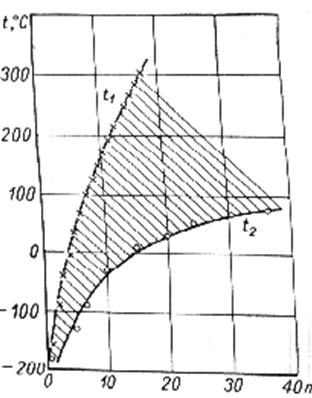
Тк=146*n1/2-17 (2)
Рис.2.1 Tп=67*n1/2+18 (3)
Например для гексана n=6, Тк=3410К, Тп=1780К.
Эти формулы дают хорошее соответствие с экспериментальными данными при 4<n<17. Для n=1,2,3,4 т.е. для углеводородов находящихся в нормальных условиях в газообразном состоянии, отклонения большие. При использовании формулы (1) таких отклонений нет.
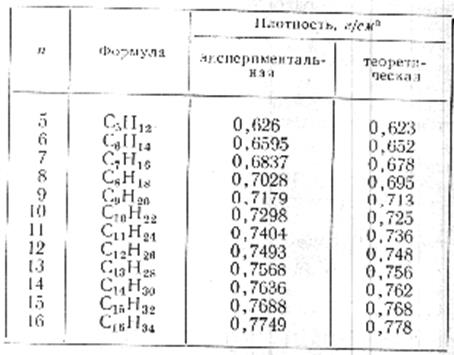
На рис.2.1 представлены зависимости температур кипения и плавления углеводородов типа Сn H2n+2. Жидкое состояние соответствует заштрихованной области. Адамчевским, полуэмпирическим путем, получены формулы (4) и (5), описывающие зависимость плотности парафинов и их вязкости от числа n. Молекулярный вес жидких парафинов М=14,026*n+2,01626 .
Плотность при комнатной температуре равна
r=14,026*n+2,01626*[16*(n+2,27)]-1, г/см3. (4)
Плотность при температуре t равна
 r=14,026*n+2,01626[16*(n+2,27)*(1+0,0194*t/n+8)]-1
(5)
r=14,026*n+2,01626[16*(n+2,27)*(1+0,0194*t/n+8)]-1
(5)
Можно также указать на зависимость от n следующих величин - теплоты сгорания, теплоты парообразования. Поскольку энергия связи С-H равна 98,7 ккал\моль, а энергия связи С-С 83,6 ккал\моль, то прирост теплоты сгорания пропорционально возрастает на каждую группу С-H2 на величину 157 ккал\моль
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.