Процесс испарения твердых тел аналогичен испарению жидкостей. Испарение твердых тел называется возгонкой или сублимацией ( от латинского «сублимаре» - возносить). На опыте легко обнаружить возгонку льда и снега. Например, зимой можно заметить уменьшение инея на ветвях деревьев с течением времени. Сушка продуктов и других материалов с помощью сублимации широко используется в различных отраслях производства.
В пищевой промышленности для понижения температуры часто пользуются «сухим льдом» (твердая двуокись углерода, СО2), который переходит непосредственно в газообразное состояние.
Часто можно наблюдать и обратный переход из газообразного состояния непосредственно в твердое, минуя жидкое состояние (десублимация). На окнах иногда зимой можно видеть быстрый рост кристалликов льда в виде красивых и разнообразных узоров на стеклах, которые образуются непосредственно из водяных паров, находящихся в воздухе.
Очевидно, что испарение твердого тела, как и испарение жидкости, происходит с поглощением теплоты. Количество теплоты, необходимое для превращения твердого тела в пар при неизменной температуре, называется теплотой сублимации.
Для одного и того же вещества теплота сублимации больше, чем теплота парообразования в жидкости, поскольку при испарении твердого тела происходит еще и разрушение его кристаллической решетки, что также требует затраты энергии (как и при плавлении). Ясно, что при десублимации выделяется такая же теплота, какая поглощается при сублимации (если внешние условия одинаковы).
Диаграмма состояния вещества. Тройная точка

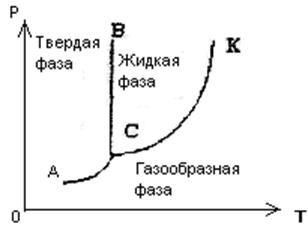 Выше говорилось, что
состояние вещества зависит от внешних условий, и в первую очередь от давления и
температуры. Поэтому для каждого вещества на основе экспериментальных данных можно составить диаграмму состояний в координатах р и Т, по которой
легко определить, в каком состоянии
будет находиться это вещество и что с ним будет происходить при изменении
внешних условий. На рисунке 36 схематически
изображена такая диаграмма для
вещества, когда в рассматриваемом пространстве,
кроме этого вещества, ничего нет. Кривая КС есть уже известная нам зависимость давления насыщенного пара взятого вещества от температуры, где К - кристаллическая точка, а С соответствует температуре затвердевания
жидкости под давление ее насыщенных паров (при потере энергии этим веществом). Кривая АС выражает зависимость
от температуры давления насыщенных паров,
находящихся над поверхностью твердого
тела. Температура плавления вещества зависит от давления, на диаграмме
линией ВС показана и эта зависимость.
Выше говорилось, что
состояние вещества зависит от внешних условий, и в первую очередь от давления и
температуры. Поэтому для каждого вещества на основе экспериментальных данных можно составить диаграмму состояний в координатах р и Т, по которой
легко определить, в каком состоянии
будет находиться это вещество и что с ним будет происходить при изменении
внешних условий. На рисунке 36 схематически
изображена такая диаграмма для
вещества, когда в рассматриваемом пространстве,
кроме этого вещества, ничего нет. Кривая КС есть уже известная нам зависимость давления насыщенного пара взятого вещества от температуры, где К - кристаллическая точка, а С соответствует температуре затвердевания
жидкости под давление ее насыщенных паров (при потере энергии этим веществом). Кривая АС выражает зависимость
от температуры давления насыщенных паров,
находящихся над поверхностью твердого
тела. Температура плавления вещества зависит от давления, на диаграмме
линией ВС показана и эта зависимость.
Каждая точка на диаграмме соответствует равновесному состоянию вещества, т.е. такому, в котором оно может находиться неопределенно долгое время. Часть диаграммы слева от линии АСВ соответствует твердому состоянию вещества; область, ограниченная линией ВСК - жидкому, а область справа от линии АС К - газообразному состоянию. Линия КС соответствует равновесию жидкой и газообразной фаз, линия ВС - равновесию жидкой и твердой фаз и АС - равновесию твердой и газообразной фаз.
При неизменных внешних условиях (р и Т), соответствующих какой-либо точке на линиях равновесия фаз АС, ВС или КС, две фазы вещества могут находиться в подвижном равновесии, при котором из одной фазы в другую переходит одинаковое число молекул. Это равновесие может сохраняться как угодно долго, если энергия не подводится к веществу и не отводится от него.
Точке С соответствуют единственные для данного вещества значения р и Т, при которых все три фазы этого вещества могут находиться в равновесии. Точку С на диаграмме состояний вещества, которая изображает равновесие между всеми тремя фазами этого вещества, называют тройной точкой. У воды, например, в тройной точке давление равно 610 Па, а температура равна 273,16 К (это температура использована для определения Кельвина).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.