а) б)
Рисунок 29 а) Электронное облако атома; б) при ковалентной связи электронные облака валентных электронов атомов перекрываются
Здесь надо иметь в виду следующее. Современный уровень физики позволяет рассчитать вероятность пребывания электрона в той или иной области пространства, занятого атомом. Эту область пространства можно изобразить в виде электронного облака, которое гуще там, где электрон чаще бывает, т. е, где больше вероятность пребывания электрона (рисунке 29 а).
Электронные облака валентных электронов двух атомов, образующих молекулу с ковалентной связью, перекрываются. Это означает, что оба валентных электрона (по одному от каждого атома) обобществляются, т. е. принадлежат обоим атомам одновременно, и большую часть времени "проводят между атомами, связывая их в молекулу (рисунке 29 б). Эта связь сильная. Примером такого рода молекул являются молекулы Н2, N2 и т. п.
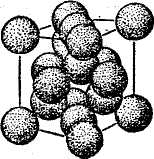
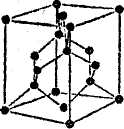
Имеется много твердых веществ с атомной решеткой. Например, алмаз, кварц, германий, кремний и др. Схематические изображения атомной решетки типа "алмаза" и упаковки атомов в ней показаны на рисунке 30. В этой решетке каждый атом образует ковалентные связи с четырьмя соседними атомами. Германий и кремний тоже имеют решетку типа алмаза. Ковалентная связь создает весьма прочные кристаллы. По этому такие вещества обладают большой механической прочностью и плавятся лишь при высоких температурах.
Молекулярная кристаллическая структура отличается пространственной решеткой, в узлах которой находятся нейтральные молекулы вещества. Силами, удерживающими молекулы в узлах этой решетки, являются силы межмолекулярного взаимодействия. Эти силы слабые. Твердые вещества с молекулярной решеткой легко разрушаются при механическом воздействии и имеют низкую температуру плавления. Примерами веществ с молекулярной пространственной решеткой является нафталин, твердый азот и большинство органических соединений.

а) б)
Рисунок 30 а) Атомная решетка типа алмаза; б) размещение атомов (каждый атом углерода окружен четырьмя ближайшими атомами).
Металлическая кристаллическая структура отличается наличием в узлах решетки положительно заряженных ионов металла. У атомов всех металлов валентные электроны, т.е. наиболее удаленные от ядра атома, очень слабо связаны с атомами. Электронные облака таких периферийных электронов перекрывают сразу много атомов в кристаллической решетке металла.
Это означает, что валентные электроны в кристаллической решетке металла не могут принадлежать одному или даже двум атомам, а обобществляются сразу многими атомами.
Такие электроны практически могут беспрепятственно двигаться между атомами.
Таким образом, каждый атом в твердом металле теряет свои периферийные электроны, и атомы превращаются в положительно заряженные ионы, а оторвавшиеся от них электроны движутся между ионами по всему объему, занятому кристаллом.
В первом приближении хаотическое движение свободных электронов в металле можно считать подобным движению молекул идеального газа. Поэтому совокупность свободных электронов в металле иногда называют электронным газом и при расчетах применяют к нему формулы, выведенные для идеального газа. (Рассчитайте таким путем среднюю скорость теплового движения электронов в металле при О 0С). Существованием электронного газа в металлах объясняются как высокая теплопроводность, так и высокая электропроводность всех металлов.
Отрицательно заряженный электронный газ, заполняющий промежутки между положительно заряженными ионами металла, является тем «цементом», который удерживает ионы в узлах решетки и придает большую прочность металлу.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.