Степень влажности воздуха имеет большое влияние на многие процессы, протекающие на Земле, например: на развитие флоры и фауны, на урожайность, на хранение изделий.
Абсолютную влажность воздуха измеряют плотностью водяного пара ρа; находящегося в воздухе, или его давлением Ра.
Относительная влажность и ее измерение
На практике влажность воздуха оценивают относительной влажностью.
Относительная влажность измеряется числом, показывающим, сколько процентов составляет абсолютная влажность ρа от давления водяного пара ρн, насыщающего воздух при имеющейся у него температуре
![]()
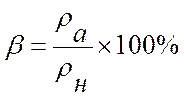
ρа и ρн берутся из таблиц.
Например: t=210 ρа = 0.0094 кг/м3
ρн = 0,0183 кг/м3
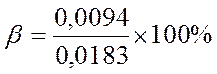
![]() 51,37%
51,37%
t=10 ρа = 0.0094кг/м3
ρн = 0.0094 кг/м3
![]() =100%
=100%
Если температура снизится до 70С, то из каждого кубического метра воздуха сконденсируется по 0,0016 кг водяного пара. Если это произошло вечером, то упадет роса.
Температура, при которой воздух в процессе своего охлаждения становится насыщенным водяным паром, называется точкой росы.
Чистый воздух может охладиться ниже точки росы, а находящийся в нем водяной пар при этом конденсироваться не будет. Такой пар называют перенасыщенным.
Объясняется это так. Для превращения пара в жидкость необходимы центры конденсации, которыми обычно служат пылинки. Пар легко конденсируется на них, если, они заряжены. Центрами конденсации могут служить и отдельные ионы. А в чистом воздухе центров конденсации нет.
Поверхностный слой жидкости
Энергия поверхностного слоя жидкости
Поверхностное напряжение
Новые понятия: ближний порядок, время оседлой жизни, поверхностное напряжение, коэффициент поверхностного натяжения, сила поверхностного натяжения, молекулярное давление.
1 Характеристика жидкого состояния: действия молекул жидкости.
2 Структура жидкости: расстояние между молекулами значительно меньше, чем в газах. Силы взаимодействия каждой молекулы с соседними достаточно велики, вследствие чего молекулы жидкости совершают колебания, около некоторых средних положений равновесия. Вместе с тем, т.к. Екср молекул жидкости сравнима с их энергией взаимодействия. Молекулы, обладая случайным избытком кинетической энергии, преодолевают взаимодействие соседних частиц и меняют центр колебания.
Практичные колеблющиеся частицы жидкости через очень малые промежутки времени (около стомиллионной доли секунды скачкообразно перемещаются в пространстве).
Жидкость состоит из множества микроскопических областей, в которых имеется некоторая упорядоченность в расположении близ лежащих частиц, меняющаяся со временем в пространстве, т.е. неповторяющаяся во всем объеме жидкости. По такой структуре говорят, что она обладает ближним порядком.
Свойства поверхностного слоя жидкости.
Молекулярное давление
Как вы знаете плотность и концентрация молекул в жидкостях при нормальных условиях больше, чем в газах. Молекулы жидкости находятся гораздо ближе друг к другу, чем молекулы газа. По этому сильное их взаимодействие больше сказывается на потенциальной энергии взаимодействия молекул.
В отличие от газа жидкость имеет определенный объем, очень слабо изменяющийся при всестороннем сжатии. В первом приближении может принять модель несжимаемой жидкости.
Сферой молярного действия данной молекулы называется часть пространства, в котором заметно взаимодействие этой молекулы с другими.
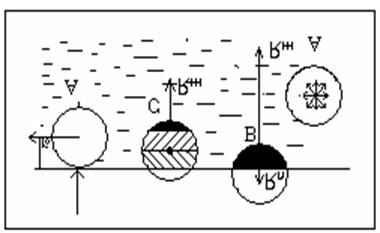 В однородной среде это пространство ограничено сферой
радиуса r0.
В однородной среде это пространство ограничено сферой
радиуса r0.
 Рассмотрим
молекулы в глубине жидкости А.
Рассмотрим
молекулы в глубине жидкости А.
Симметричные молекулы из ее сферы молекулярного действия притягивают центральную с равными и противоположными направленными силами, так что равнодействующая всех сил взаимодействия действует на выбранную молекулу, равно 0. Рассмотрим теперь молекулу В на поверхности жидкости. Все молекулы жидкости, действующие на неё можно перебрать попарно, симметрично, относительно перпендикуляра к поверхности, т.к. равнодействующая сил взаимодействия с данной молекулой направлены по этому перпендикуляру. Равноденствие всех таких сил направленно по перпендикуляру к поверхности в глубь жидкости, т.к. аналогичная равнодействующая со стороны молекул пара гораздо меньше (концентрация молекул пара в обычных условиях много меньше концентрации молекул жидкости).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.