Разностные синтезы Фурье
широко используют в большинстве структурных исследований белков. Они особенно
полезны в тех случаях, когда имеется много положений присоединения тяжелых
атомов. Однако отмечается, что применять эти синтезы следует с большой осторожностью.
Это, в частности, относится к выбору фаз ![]() ,
так как основное влияние на синтезы Фурье оказывают именно фазы, а не
амплитуды. Поэтому положения атомов, найденные с помощью разностных синтезов
Фурье, следует всегда сопоставлять с данными, полученными на основе синтеза
Паттерсона. Только тогда положения тяжелых атомов можно считать правильными,
если они подтверждаются этим синтезом.
,
так как основное влияние на синтезы Фурье оказывают именно фазы, а не
амплитуды. Поэтому положения атомов, найденные с помощью разностных синтезов
Фурье, следует всегда сопоставлять с данными, полученными на основе синтеза
Паттерсона. Только тогда положения тяжелых атомов можно считать правильными,
если они подтверждаются этим синтезом.
После того как положения
тяжелых атомов определены, рассчитывают структурный фактор тяжелого атома ![]() . Следует иметь в виду, что
использование синтезов Паттерсона и разностных синтезов Фурье дает лишь
приближенные положения тяжелых атомов. Поэтому для более четкой локализации этих
атомов имеются методы, которые позволяют уточнить координаты тяжелых атомов на
основе имеющихся экспериментальных данных. Для контроля за ходом уточнения в
принципе могут быть рассчитаны различные величины. В рентгеновской
кристаллографии эффективность уточнения обычно контролируют фактором расходимости
R:
. Следует иметь в виду, что
использование синтезов Паттерсона и разностных синтезов Фурье дает лишь
приближенные положения тяжелых атомов. Поэтому для более четкой локализации этих
атомов имеются методы, которые позволяют уточнить координаты тяжелых атомов на
основе имеющихся экспериментальных данных. Для контроля за ходом уточнения в
принципе могут быть рассчитаны различные величины. В рентгеновской
кристаллографии эффективность уточнения обычно контролируют фактором расходимости
R:
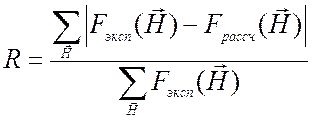 , (2.22)
, (2.22)
где суммирование проводится по всем отражениям. В случае уточнения положений тяжелых атомов для отражений общего вида обычно используют R-фактор по Крауту:
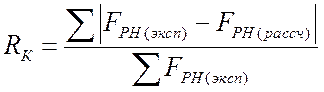 .
(2.23)
.
(2.23)
Для центросимметричных
зон рассчитывают также величину ![]()
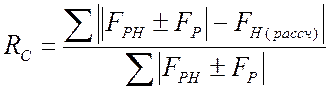 .
(2.24)
.
(2.24)
В кристаллографии белка сложно указать какие-то даже приблизительные значения R-фактора, так как его величина зависит как от разрешения, точности измерений, числа положений тяжелых атомов, так и от многих других причин.
Таким образом, в случае
использования одного изоморфного производного фазы определяются однозначно,
если векторы ![]() ,
, ![]() и
и
![]() коллинеарны. Это имеет место в
центросимметричных кристаллах, где фазы, как правило, равны 0 или p. Так как молекулы белков существуют
в одной из двух возможных энантиоморфных форм, то они всегда кристаллизуются в нецентросимметричных
структурах. Тем не менее, в некоторых пространственных группах (например, Р21)
проекция структуры вдоль определенного направления центросимметрична и, таким
образом, будут центросимметричными также некоторые двумерные зоны. Векторы
коллинеарны. Это имеет место в
центросимметричных кристаллах, где фазы, как правило, равны 0 или p. Так как молекулы белков существуют
в одной из двух возможных энантиоморфных форм, то они всегда кристаллизуются в нецентросимметричных
структурах. Тем не менее, в некоторых пространственных группах (например, Р21)
проекция структуры вдоль определенного направления центросимметрична и, таким
образом, будут центросимметричными также некоторые двумерные зоны. Векторы ![]() ,
, ![]() и
и
![]() для таких зон будут коллинеарны.
Поэтому фаза
для таких зон будут коллинеарны.
Поэтому фаза ![]() определяется однозначно, если
известны величины
определяется однозначно, если
известны величины ![]() ,
, ![]() и
и
![]() . В результате этого белки,
кристаллизующиеся в пространственных группах с центросимметричными проекциями,
создают преимущества при использовании метода однократного изоморфного
замещения, так как фазы этих проекций можно довольно легко определить.
. В результате этого белки,
кристаллизующиеся в пространственных группах с центросимметричными проекциями,
создают преимущества при использовании метода однократного изоморфного
замещения, так как фазы этих проекций можно довольно легко определить.
Отметим, что полное определение фаз центросимметричных зон не позволяет определить трехмерную структуру сложного белка. Однако оно очень полезно на начальных стадиях исследования тяжелоатомных производных для нахождения положения тяжелого атома и для оценки ошибок.
Что касается отражений общего вида, то фазовая неопределенность, характерная для метода однократного изоморфного замещения, может быть преодолена путем использования хотя бы двух производных.
Использование двух
изоморфных производных приводит к построению Харкера, представленному на рис.
2.11. Этот рисунок является развитием рис. 2.10, из которого следовало, что
положение вектора ![]() в случае первого
тяжелоатомного производного (
в случае первого
тяжелоатомного производного (![]() - вектор вклада первого тяжелоатомного
производного) соответствует отрезкам OH и OG.
Теперь проводится также вектор -
- вектор вклада первого тяжелоатомного
производного) соответствует отрезкам OH и OG.
Теперь проводится также вектор -![]() , который
соответствует вкладу тяжелого атома второго производного. Два возможных
положения вектора
, который
соответствует вкладу тяжелого атома второго производного. Два возможных
положения вектора ![]() заданы отрезками OH и OL. Из рисунка видно, что отрезок OH, соединяющий точку O и точку H пересечения трех окружностей, однозначно определяет
вектор
заданы отрезками OH и OL. Из рисунка видно, что отрезок OH, соединяющий точку O и точку H пересечения трех окружностей, однозначно определяет
вектор ![]() . Если векторы
. Если векторы ![]() и
и ![]() коллинеарны,
то, как следует из рис. 2.11, второе производное не может помочь в устранении
фазовой неопределенности. По этой и ряду других причин (например, большие
погрешности в определении величин
коллинеарны,
то, как следует из рис. 2.11, второе производное не может помочь в устранении
фазовой неопределенности. По этой и ряду других причин (например, большие
погрешности в определении величин ![]() ,
, ![]() ,
, ![]() и
и
![]() ) обычно используют информацию о
фазах от более чем двух тяжелоатомных производных.
) обычно используют информацию о
фазах от более чем двух тяжелоатомных производных.
|
|
Рис. 2.11. Построение Харкера для определения фаз
методом двух изоморфных замещений
Каковы требования к тяжелым атомам? Прежде всего присоединение тяжелого атома должно позволить измерять различия интенсивностей на рентгенограммах нативного белка и изоморфного производного. Поэтому различия, обусловленные вкладом тяжелого атома, должны быть больше, чем погрешности их измерения.
Пусть ![]() - число тяжелых атомов с фактором рассеяния
- число тяжелых атомов с фактором рассеяния ![]() , а
, а ![]() - число одинаковых легких атомов белка
с фактором рассеяния
- число одинаковых легких атомов белка
с фактором рассеяния ![]() . Тогда среднее изменение
интенсивности ацентричных отражений, которое вызвано присоединением тяжелых
атомов, может быть оценено с помощью следующего выражения:
. Тогда среднее изменение
интенсивности ацентричных отражений, которое вызвано присоединением тяжелых
атомов, может быть оценено с помощью следующего выражения:
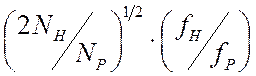 .
.
Например, присоединение
атома ртути, имеющего 80 электронов, к белку с молекулярной массой около 24000
приводит к среднему изменению интенсивности примерно на 40 %, что значительно
превосходит стандартную погрешность измерения интенсивностей. Можно отметить,
что для более крупных белков требуются более тяжелые атомы, а для очень больших
белков – так называемые металлические кластеры, например (![]() ,
, ![]() .
.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.