





Билет №2
Задача1. 1) для паров-й конверс-и метана при t=900грС или Т=1173К:
DН0298=[ 3*0+1*(-110,53)]-[-74,85-241,81]=206,13кДж,
DS0298=(130,52*3+197,55)-(188,72 +186,27)=214,12Дж/К,
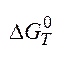 =206,13-1173*0,21412=-45,03кДж.
=206,13-1173*0,21412=-45,03кДж.
2) Д/паров конв-и СО при t=300грС или Т=573К:
DН0298= (-393,51) –(-110,53-241,81)= - 41,17 кДж,
DS0298=(130,52*3+213,66)-(197,55+188,72)= - 42,09Дж/К,
![]() = - 41,17-573*(-0,04209)= - 20,91кДж.
= - 41,17-573*(-0,04209)= - 20,91кДж.
Задача2. lgK= - 9840/Т+8,343lgТ-2,059-3 Т+0,178*10-6Т2-11,96, t=900грС или 1171К.
Для реакц-и (1): lgK=3,0881, К=1225
Билет №5
Задача: Равнов-е реакции конверсии СО:
lgК=2485,5/Т+1,565*lgТ-0,066*10-3*Т+0,207 *105/ Т2 –6,946.
Напишите эту р-цию, рассч-те К при 400гр.
Расчет: СО+Н2О«СО2+Н2О, Н = -41.
Т=400+273=673 К.
lgК = 1,0829Þ К=12,103.
Билет №7
Задача. Горяч конвертир-й газ, выход их шахтной печи, послед-но охлаж-ся в 2-х кот-утил-х. Рассч-ть кол-во утилиз тепла в котле 1, если состав влаж газа после шахт печи след-й (%об): Н2 – 37; N2 – 14; CO – 8; CO2 – 5; СН4 – 0,3; Н2О – остальное. Тем-ра газа на входе в котел 1 сост-ет 1027 гр, а на выходе из котла 627 гр. Расчет вып-ть на 10 м3 влаж газа.
Решение: 1) кол-во утилиз-го тепла:
DQ = Qнач - Qкон = V*cвх*tвх - V*cвых*tвых.
2) найдем теплоемкости при 1027гр (1300 К): рассчитаны по ур-ям:
в кДж/кмольК - СN2 = 31,292; CCH4=61,388; ССО2 = 49,158; СН2О = 38,635; СН2 = 30,014; ССО = 31,567.
в кДж/м3К - СN2 = 1,397; CCH4=2,741; ССО2 = 2,195; СН2О = 1,725; СН2 = 1,34; ССО = 1,409.
3) найдем теплоемкости при 627гр (900 К): рассчитаны по ур-ям:
в кДж/кмольК - СN2 = 30,438; CCH4=52,261; ССО2 = 46,371; СН2О = 36,527; СН2 = 29,419; ССО = 30,694.
в кДж/м3К - СN2 = 1,359; CCH4=2,333; ССО2 = 2,07; СН2О = 1,631; СН2 = 1,313; ССО = 1,37.
4) DQ=10*(1,397*0,14+2,741*0,003+2,195*0,05+1,725*0,357+1,34 *0,37+1,409*0,08)*1027 - 10*(1,359*0,14+2,333*0,003+2,07*0,05+1,631 * 0,357 +1,313 *0,37+1,37*0,08)* 627=15794,2 – 9269,8 = 6524,4 кДж.
Билет №10
Задача: Рассч-ть по ур-ю Михельса: 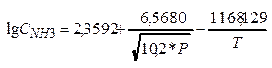 величину
величину
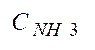 после I и II ступени конд-ции. Укажите смысл пар-ра
после I и II ступени конд-ции. Укажите смысл пар-ра 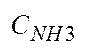 .
.
Конден-я проис-т при след усл-х: I ступень: Р=23 МПа, t=30 гр.; II ступень: Р=25 МПа, t= -10 гр. Выч-те степ извлеч-я аммиака из газа на I ступени и общую, если об.доля NH3 в газе на входе в I ступень равна 15%.
Расчет: 1 ступень lg C'NH3 = -1,067 Þ C'NH3 = 0,0857, т.е. 8,57%об.; 2 ступень lg C''NH3 = -1,671 Þ C''NH3 = 0,0213, т.е. 2,13%об.; степень извлеч-я NH3 из газа на 1 ст:
(15-8,57)*100/15=42,87%; общ-я степ извлеч-я
Билет №11, 13
Задача1: Время окисл-я аммиака на платиноидном катал-ре при 900 гр сост-ло 8,34*10-5 с. Время окисл-я t и степень конверсии аммиака до NO a связаны след ур-м: lgt = -0,107a+7,02*10-6 *a3. Рас-те вел-ну a.
Реш-е: Величину a рассч-и методом подбора. lgt = -4,08Þ -4,08= -0,107a+7,02*10-6 a3. После подбора пол-м a = 96%, т.е. -4,08= -4,08.
Задача 2: В контак апп-те прот-т р-ция: 2NH3+2,5 O2= 2NО +3Н2О, DН= -453,5 кДж при эт прореаг-о 40 кг аммиака. Какой V воз-ха пост-л при эт в конт апп-т, если его избыток сос-л 30%, ск-ко тепла выд-ось.
Реш-е: 1) Объем прореаг-го аммиака: 40*22,08/17 = 51,95 м3.
2) Объем О2, подан. в конт. ап-т: 51,95*2,5*1,3/2 = 84,42 м3.
3) Объем воз-ха сост-т: 84,42*100/21 = 401,9 м3.
4) Кол-во выдел-гося тепла: на 2*0,02208 м3 NH3 ------ 453,5 кДж, а на
51,95м3 NH3 ---- х кДжÞ х = 533499,2 кДж.
Билет №14
Задача: Расчет ст-и окисл-я NO в NO2. Объемн расход нитрозного газа через полый аппарат-окислитель (V=30 м3) сост-ет 55000 нм3/ч. Объемн-я доля NO в газе на входе в аппарат равна 2,6 %, а кислорода – 4,0 %. Абс-е давл-е сост-ет 7ат., а темп-ра – 80 С. Рассч-ть ст-нь окисл-я NO в рез-те прохожд-я нитрозного газа через окислитель и объем образов-гося NO2.
Расчет: 1) 2 NO+О2«2 NO2, Н= -114;
Уравн-е
д/расчета ст-и окисл-я NO: t* k* а2*Р2
= 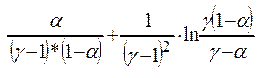 (1). Вычисляем время пребывания газа
в окисл-ом объеме, t (с). Д/этого необх-мо рассчитать расход газа с учетом
реал-го давл-я и темп-ры.
(1). Вычисляем время пребывания газа
в окисл-ом объеме, t (с). Д/этого необх-мо рассчитать расход газа с учетом
реал-го давл-я и темп-ры.
Испол-м ур-е Клапейрона: 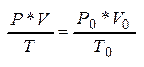 Þ
Þ
![]() =
1*55000*(273+80)/(273*7)= 10159,6 (м3/ч) = 10159,6/ 3600=2,822 (м3/с);
t=30 /2,822 =10,68 (с).
=
1*55000*(273+80)/(273*7)= 10159,6 (м3/ч) = 10159,6/ 3600=2,822 (м3/с);
t=30 /2,822 =10,68 (с).
2)Конст-ту ск-ти при 80 гр опред-ем из справ данных: k=(0,00292+0,00195)/2=0,002435(1/%об2*с);
3) а=2,6/2=1,3 % об;
4) g=4/1,3=3,07
Билет №18
Задача: ХГ на выходе из абсорбционной колонны содержат 3,3%об. О2 и 0,2%об. NО. Расход ХГ-30000 нм3/ч. Газ подается на каталитическую очистку. Рассчитайте кол-во реакционного тепла и расход восстан-лей д/след вар-тов:
1. Неселективная очистка по р-ям: 2О2+СР4=СО2+2Н2О, ΔН= -803 (1), при этом остаточное содержание О2 в газе составляет 0,3% об.; 4NO+СН4=2N2+СО2+2Н2О, ΔН= -1165 (2), при этом NO расходуется полностью.
2. Селективная очистка по р-и: 6NO+4NH3=5N2+6Н2О, ΔН= -1811, при этом NO расходуется полностью.
Расчет: Рассмотрим р-ю (1):
1) Найдем какое кол-во О2 прореагировало: 30000*0,033-30000*0,003 = 900 нм3/ч.
2) Найдем сколько расходуется СН4: 900/2=450 нм3/ч.
3) Найдем кол-во реакционного тепла, выделяется при неселективной очистке: 2*0,0224 м3----803кДж, 900 м3-----х1 кДжÞ х1=16131,7 кДж. Рассмотрим р-ю (2):
4) Найдем какое кол-во NO прореагировало: 30000*0,002=60 нм3/ч.
5) Находим расход СН4: 60/4=15 нм3/ч
.6) Находим общий расход восстановителей по р-ям (1) и (2): 450+15=465 нм3/ч.
7) Найдем кол-во тепла, выделяющееся по р-ции (2): 4*0,0224 м3----1165кДж, 60 м3-----х2 кДжÞ х2=780,13 кДж.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.