



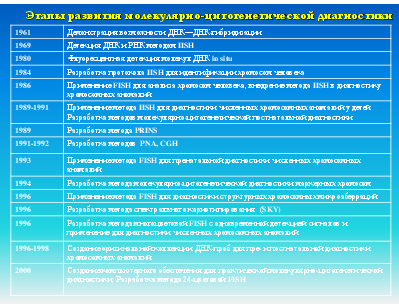












































устройство цифрового захвата микроскопического изображения (CCD-камера); компьютер с соответствующим программным обеспечением; стандартная лабораторная аппаратура (термостат, центрифуга, водяная баня, предметные и покровные стекла и т. д.).
Материал исследования
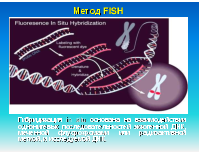
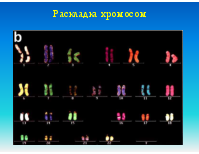
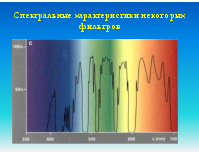
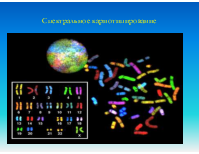
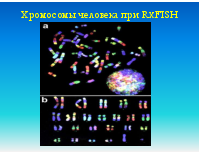
Кровь, костный мозг, биопсия опухоли, плацента, эмбриональные ткани или амниотическая жидкость. Образцы для исследования должны доставляться в лабораторию в свежем виде. Препараты (слайды) готовятся непосредственно из образцов ткани или после их культивирования. Могут использоваться как метафазные, так и интерфазные препараты клеток. Меченные флуоресцентными метками специфические ДНК-зонды гибридизуюся с хромосомной ДНК, причем можно одновременно использовать множественные зонды к разным локусам
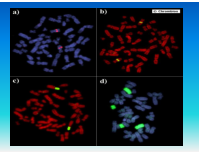
FISH используется при выявлении количественных и качественных хромосомных аберраций, таких как делеции (в том числе и микроделеции), транслокации, удвоение и анэуплоидия. FISH на интерфазных хромосомах служит быстрым методом пренатальной диагностики трисомий по 21, 18 или 13 хромосомам или аберраций половых хромосом. В онкологии с помощью FISH можно выявлять рад транслокаций, связанных с гематологическими злокачественными новообразованиями. Метод также может использоваться для мониторинга остаточных явлений онкозаболевания после химиотерапии и пересадки костного мозга и выявления усиленных онкогенов (c-myc/n-myc), связанных с неблагоприятным прогнозом в отношении некоторых опухолей. FISH также используется для контроля приживаемости аллотрансплантата костного мозга, полученного от индивида противоположного пола.
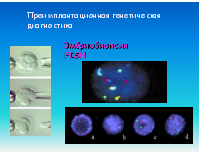
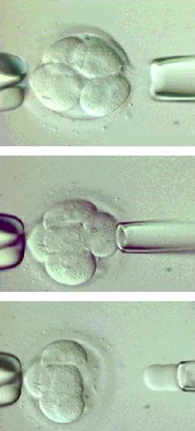
Преимплантационная генетическая диагностика
Эмбриобиопсия FISH
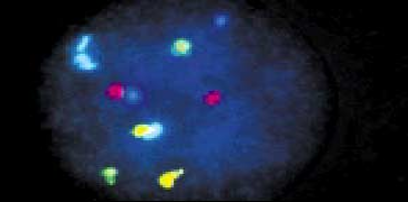
ДНК-зонды представляют собой клонированные фрагменты ДНК генома человека, при гибридизации которых с метафазными хромосомами или интерфазными клетками можно определить особенности хромосомного набора и наличие хромосомных нарушений. Новая коллекция включает оптимизированные ДНК-зонды, клонированных в ВАС (bacterial artificial cromosome), YAC (yeast artificial cromosome) клонов, а также PAC (phage artificial cromosome) векторах.
Виды ДНК-зондов
FISH Probes
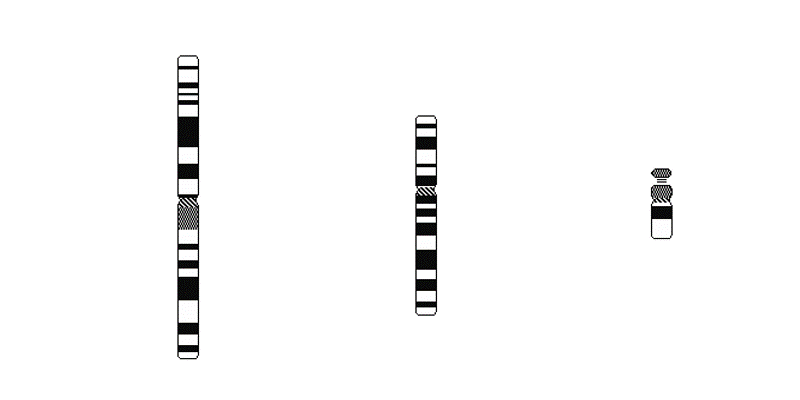
telomere
centromere
Whole chromosome paint
locus specific
Центромерные пробы или хромосомные нумераторы CEP
Это хромосомо-специфические ДНК-пробы, состоящие из высокоповторяющихся последовательностей ДНК. Эти повторы располагаются преимущественно в центромерных или прицентромерных гетерохроматиновых участках хромосом, обладают полной или относительной специфичностью к этим районам индивидуальных хромосом.
Применение CEP
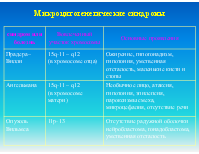
в диагностике численных хромосомных нарушений (моносомии и трисомии по отдельным хромосомам) как на хромосомных препаратах, так и на интерфазных ядрах в пренатальной цитогенетической диагностике, особенно в исследованиях хориальной ткани, когда не всегда возможно получение качественных хромосомных препаратов или требуется быстрое цитогенетическое заключение при риске на распространенные хромосомные болезни, обусловленные нерасхождением хромосом
Комбинации СЕР широко используются для определения численных аномалий хромосом 13, 18, 21, X и Y, при хромосомном анализе онкологических заболеваний является изучение числа хромосом 3, 7, 17 при карциноме мочевого пузыря. Эта техника не может дифференцировать нормальную хромосому и ее дериват, содержащий лишь небольшой район исходной хромосомы, в котором локализованы последовательности ДНК, гомологичные ДНК СЕР. Как следствие, этот метод не способен дифференцировать нормальный кариотип 46,XX и достаточно часто встречающийся вариант хромосомной патологии, приводящей к синдрому Шерешевского — Тернера: 46,X+mar, при котором маркерная хромосома содержит прицентромерный район Х-хромосомы.
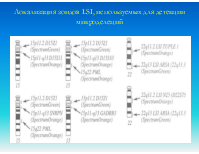
Локус специфические пробы LSI
LSI - ДНК-пробы для обнаружения микроделеций хромосомных районов, приводящих к различным патологиям развития. Это клонированные уникальные последовательности ДНК, локализованные в районе, потеря которого приводит к развитию синдрома.
Локализация зондов LSI, используемых для детекции микроделеций
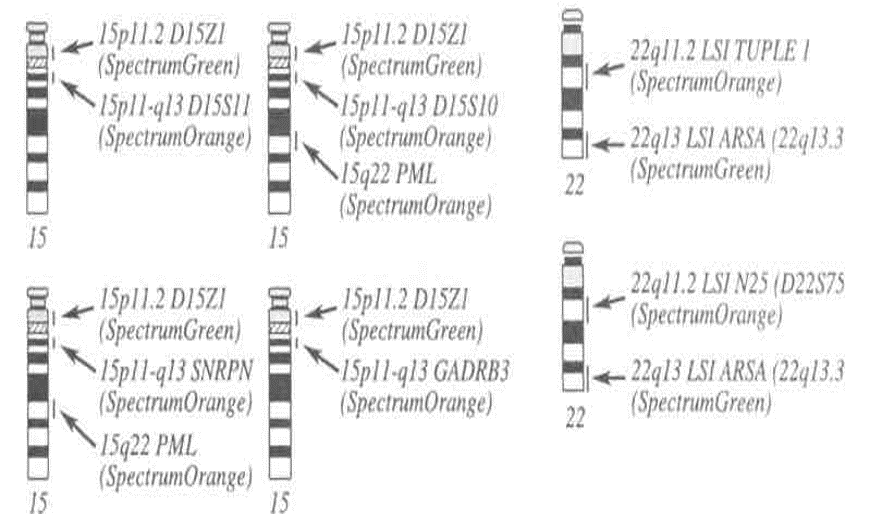
Микроцитогенетические синдромы

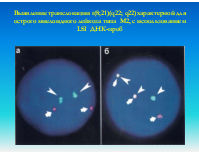
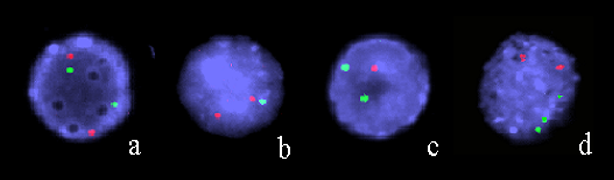
Выявление транслокации t(8;21)(q22; q22)характерной для острого миелоидного лейкоза типа М2, с использованием LSI ДНК-проб
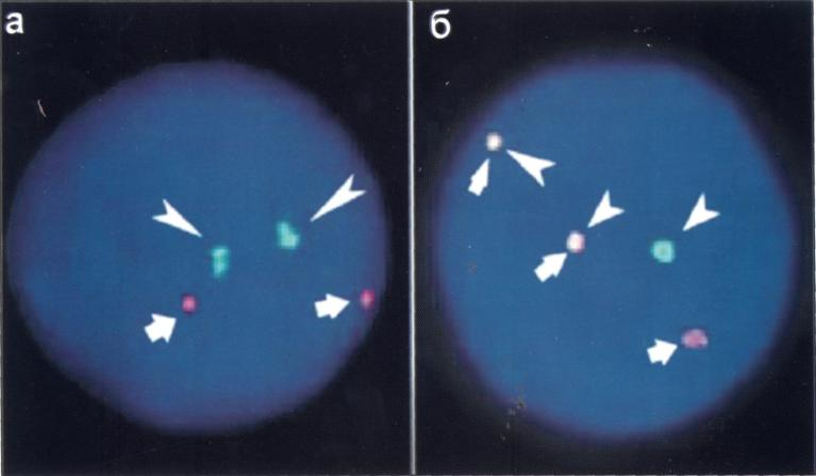
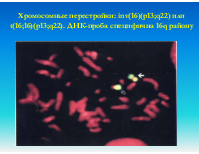
Хромосомные перестройки: inv(16)(p13;q22) или t(16;16)(p13;q
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.