Кк – коэффициент нормальности кислоты;
Э – эквивалентный вес щелочи;
V – объем пробы, взятой для титрования в мл;
1000 – перевод мг в г;
100 – перевод в %.
3.2.7. Аммиак.
3.2.7.1. Применяемые реактивы:
- кислота соляная (серная), 0,1н раствор;
- метилоранж, 0,1%-ный раствор.
3.2.7.2. Выполнения анализа.
В колбу емкостью 250 мл, отберите 100 мл раствора аммиака, добавьте 2-3 капли раствора метилоранжа и титруйте 0,1н раствором кислоты до перехода окраски из желтой в оранжевую.
3.2.7.3. Обработка результатов.
Концентрацию аммиака, в %, определите по формуле:
![]()
NН3, г/л =А![]() 0,017
0,017
для пробы =100 мл и Nкисл.=0,1
где:
А – расход кислоты на титрование пробы, мл;
N – нормальность кислоты;
К – коэффициент нормальности кислоты;
Э – эквивалент аммиака;
V – объем пробы, взятой для титрования, мл;
1000 – перевод л в мл;
100 – перевод в %.
3.2.8. Гидразин.
3.2.8.1. Применяемые реактивы:
- гипосульфит натрия, 0,1н раствор;
- йод, 0,1н раствор;
- кислота серная, 2н раствор;
- натр едкий, 2н раствор;
- крахмал, 1%-ный раствор.
3.2.8.2. Выполнение анализа.
В коническую колбу отберите 5 мл раствора гидразина, добавьте дистиллированную воду до 100 мл, а затем введите 2-3 капли 2н раствора щелочи и точно 10 мл 0,1н раствора йода. Хорошо перемешайте жидкость и поставьте в темное место и спустя 3 минуты добавьте 2,5 мл. 2н раствора серной кислоты. Затем, оттитруйте избыток йода 0,1н раствором гипосульфита натрия до соломенно-желтого цвета. Добавьте в конце титрования 1 мл крахмального раствора и продолжайте титрование до исчезновения синей окраски.
Все операции выполняйте в конических колбах емкостью 250-300 мл снабженных стеклянными притертыми пробками.
Параллельно с анализом проводите холостой опыт, для чего к 100 мл дистиллированной воды добавьте 2 мл 2н раствора щелочи и 10 мл 0,1н раствора йода. Спустя 3 минуты добавьте 2,5 мл 2н серной кислоты и титруйте 0,1н раствором гипосульфита натрия в присутствии крахмала.
3.2.8.3. Обработка результатов.
Концентрацию гидразина, мг/л, рассчитайте по формуле:
где:
Ах и А – расходы 0,1н раствора гипосульфита натрия на титрование холостой и анализируемой пробы;
N – нормальность раствора гипосульфита натрия;
К – коэффициент раствора нормальности гипосульфита натрия;
8 – эквивалент гидразина в данной реакции, равный четверти его молекулярного веса.
3.2.9. Фосфаты.
3.2.9.1. Тринатрий фосфат.
3.2.9.1.1.Применяемые реактивы:
- кислота соляная (серная), 0,1н раствор;
- фенолфталеин, 0,1%-ный раствор;
- метилоранж, 0,1%-ный раствор.
3.2.9.1.2. Выполнение определения.
В коническую колбу отберите 5 мл анализируемого раствора, добавьте 95 мл обессоленной воды, 2 капли фенолфталеина и титруйте 0,1н раствором кислоты до исчезновения розовой окраски. Заметьте расход кислоты (А) мл, затем добавьте 2-3 капли метилоранжа и продолжайте титрование до перехода окраски из желтой в оранжевую. Запишите общий расход кислоты, с самого начала титрования (В).
3.2.9.1.3. Обработка результатов.
А – расход 0,1н раствора кислоты на титрование анализируемой пробы по фенолфталеину, мл;
В – общий расход 0,1н раствора кислоты на титрование анализируемой пробы по метилоранжу с самого начала тирования, мл;
К – коэффициент нормальности 0,1н раствора кислоты;
1000 – приведение к литру;
5 – объем пробы, взятой для титрования, мл;
Расчет гидратной щелочности и содержания едкого натра в щелочно-фосфатном растворе.
Щг.=2Щфф. - Щобщ., мг-экв/л.
![]()
где:
NаОН - содержание едкого натра в щелочно-фосфатном растворе, г/л;
Щг - величина гидратной щелочности, мг-экв/л;
Щф.ф. – щелочность по фенолфталеину, мг-экв/л;
Шобщ. – щелочность общая, мг-экв/л;
40 – эквивалентный вес едкого натра;
1000 – перевод в граммы.
Расчет содержания фосфатов в щелочно-фосфатном растворе:
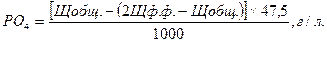
где:
РО4 – содержание фосфатов в щелочно-фосфатном растворе, г/л;
Щф.ф. – щелочность по фенолфталеину, мг-экв/л;
Щобщ. – щелочность общая, мг-экв/л.;
47,5 – эквивалентный вес тринатрийфосфата при титровании его до мононатрийфосфата (по метилоранжу);
1000 – перевод в граммы.
Пример:
На титрование пошло 5 мл щелочно-фосфатного раствора по фенолфталеину 3 мл (А) 0,1н раствора кислоты, общий расход кислоты по метилоранжу от начала титрования 4,5 мл (В) 0,1н раствора кислоты, К=1.
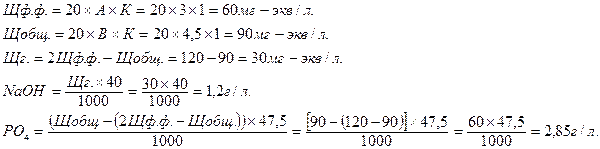
![]()
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.