Лекция 10
Катализ и катализаторы
План
10.1 Катализ и катализаторы 10.2 Кинетика фер-ментативных реак-ций.
10.1 Катализ – это явление изменения скорости реакции под влиянием ве-ществ, называемых катализаторами.
Катализаторы – это вещества, изменяющие скорость химической реак-ции, но не изменяющиеся в ходе процесса ни качествен-но, ни количественно. Они не входят в состав продуктов реакции.
Небольшие количества катализаторов способ-ны существенно изме-нить скорость взаимо-действия большого ко-личества реагирующих веществ.
Катализаторы гомогенные в одной фазе с реагирую-щими ве-ществами гетерогенные в разных фа-зах с реагиру-ющими вещес-твами
Пример гетерогенного катализа
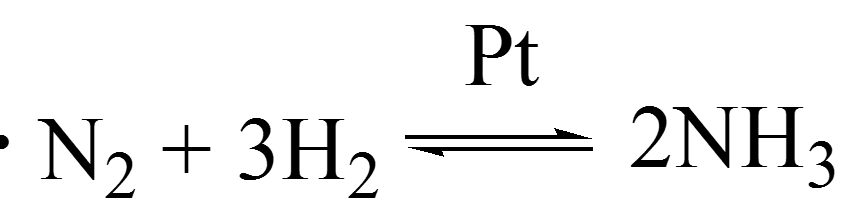
Пример гомогенного катализа
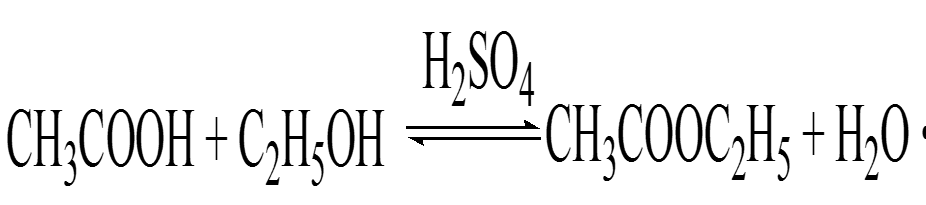
Катализаторы положительные увеличивают скорость реакции отрицательные уменьшают скорость реакции
Ингибаторы – вещества, уменьша-ющие скорость реак-ции, но расходую-щиеся при этом сами.
С точки зрения теории активного комплекса механизм действия катализаторов в том, что они изменяют высоту энергетического барьера химической реакции.
Без катализатора: А + В ↔ А...В → АВ В присутствии катали-затора: А + В + К↔ А...К...В → → АВ + К
Положительный катализатор снижает энергетический барьер реакции
Без катали-затора
С положи-тельным катализато-ром
Энергия, кДж/моль
Координата реакции
Под воздействием поло-жительного катализатора в реакционной смеси возрастает доля актив-ных молекул при данной температуре. Скорость реакции увеличивается.
Отрицательный катализатор повышает энергетический барьер реакции
С отрица-тельным ка-тализатором
Без катали-затора
Энергия, кДж/моль
Координата реакции
Под воздействием отри-цательного катализатора в реакционной смеси снижается доля актив-ных молекул при данной температуре. Скорость реакции уменьшается.

Частным случаем катализа является автокатализ: ката-лизатором служит один из продуктов реакции.
Пример автокаталити-ческой реакции: 2 KMnO4 + 5 H2C2O4 + 3 H2SO4 → 2 MnSO4 + 10 CO2 + K2SO4 + 8 H2O Катализатор: Mn2+
Кинетическая кривая автокаталитической реакции
Концентрация, моль/л время
Разрушение озоново-го слоя Земли – пример гомогенного катализа, протекаю-щего в атмосфере под воздействием фреонов.
Фреоны – это фторо-хлороуглеводороды (СF2Cl2), применяемые как хладаген-ты. При обычных условиях они отличаются высокой устойчивостью к разложе-нию.
В атмосфере происходит разложение фреонов под воздействием ультрафиолето-вого излучения солнца:
CF2Cl2 CF2Cl• + Cl•
Cl• - катализатор разложения озона
Без катализатора процесс протекает по схеме:
O3 + O 2 O2 Eак = 17,1 кДж/моль
В присутствии катализатора:
O3 + Cl ClO + O2 Eак= 2,1 кДж/моль
ClO + O Cl + O2 Eак = 0,4 кДж/моль
Cl
O3 + O 2 O2
Присутствие катализатора существен-но снижает энергетический барьер реакции, увеличивая скорость раз-ложения озона.
Энергия, кДж/моль
О3+ О
2О2
Координата реакции
Вещества, усиливаю-щие действие катализа-торов, называются про-моторами
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.