Лекция 12
Химическая связь
Проблема химической связи – это центральная проблема химии, т.к. любой химический процесс включает в себя разрыв старых и образование новых связей между атомами.
П Л А Н 12.1 Химическая связь и ее типы. 12.2 Ковалентная связь. 12.3 Водородная связь.
12.1 Химическая связь – результат взаимодействия двух или более атомов, приводящий к образованию устойчивой многоатомной системы.
Частным случаем таких систем является молекула. Молекула – это устойчи-вая электронейтральная система, состоящая из вза-имодействующих электро-нов и ядер.
Природа сил, действую-щих в многоатомных сис-темах, электрическая: притяжение разноименно заряженных частиц. Носи-телями зарядов в ве-ществе являются ядра и электроны.
По характеру рас-пределения заря-женных частиц в веществе различа-ют несколько типов химической связи.

Силы межмолекулярного взаимодействия

Энергия связи (Е, кДж/моль) – это энергия, необходимая для разрыва химической связи в одном моль вещества, находящегося в газообразном состоянии.
Чем больше энер-гия связи, тем прочнее химичес-кая связь.
Энергетический подход к описанию химической связи
Образование химической связи энергетически выгодно, так как энергия связанной системы меньше, чем суммарная энергия изолиро-ванных атомов: А + В → АВ Е(A) + Е(B) > Е(AB)
Кривая потенциальной энергии молекулы Н2
Область отталкивания
Энергия, кДж/моль
R
Область притяжения
0,074 нм
0,074 нм – это длина связи в молекуле H2. Длина связи – это расстояние между атомами в молекуле.
Ковалентная связь (КС) – самый распространен-ный тип химической связи. В органических соединениях практичес-ки все связи являются ковалентными.
Существует два кван-тово-механических подхода к описанию КС: метод валентных связей (ВС) и метод молекулрных орбита-лей (МО).
Оба метода разра-ботаны в 30-е годы 20-го века и имеют свои достоинства и недостатки.
12.2.1 Основные положения метода ВС.
1. В образовании КС участвуют только валент-ные электроны. Валент-ными называются элект-роны, наиболее удален-ные от ядра.
Валентность атома можно предсказать по числу неспаренных электронов в его стационарном и воз-бужденных состояниях.
Валентные возможности атома серы
Стационарное состояние атома
3 d
3p
B = II
3s
Валентные возможности атома серы
Возбужденное состояние атома-1
3 d
3p
B = IV
3s
Валентные возможности атома серы
Возбужденное состояние атома-2
3 d
3p
B = VI
3s
Общая валент-ность равна числу орбиталей атома, участвующих в об-разовании связей.
2. Единичную КС образуют 2 электрона с антипараллельными спинами, принадлежа-щими двум атомам (общая электронная пара).
Ковалентная связь – это химическая связь, образованная при помощи общих электронных пар, при-надлежащих двум или более атомам.
Механизм образования КС
Донорно-акцептор-ный
Обмен-ный
Обменный механизм – обобществление неспа-ренных электронов вза-имодействующих атомов
H
H H
H
Донорно-акцептор-ный механизм – атом-донор отдает неподелен-ную электронную пару на вакантную орбиталь атома-акцептора
● ●
NH3 +
H+
+
H
N
H
H
H
● ●
H2O +
H+
+
O
H
H
H
Кратность связи (n) равна числу общих электронных пар: Н – Н n = 1 O = O n = 2 N ≡ N n = 3
Увеличе-ние прочнос-ти связи
3. С точки зрения волновых представле-ний, образованию общей электронной пары со-ответствует перекрыва-ние АО взаимодействую-щих атомов.
При этом, в межъ-ядерном пространстве возникает область повышенной элект-ронной плотности.
Способы перекрывания АО
Осевое
Боковое
Ось молекулы –это условная линия, соединя-ющая ядра ато-мов в молекуле
Способы осевого перекрывания АО

Способы осевого перекрывания АО

s - рх
Способы осевого перекрывания АО
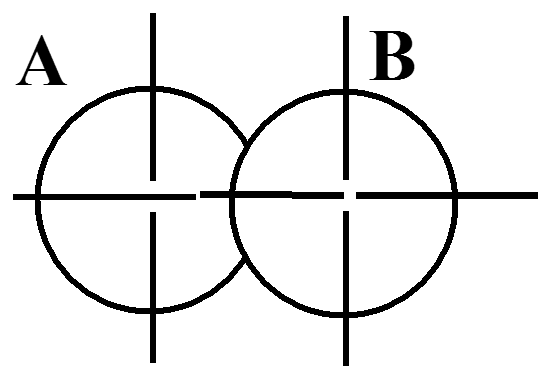
s - s
При осевом пере-крывании орбиталей образуется разно-видность ковалент-ной связи, называ-емая σ- связью.
Способы бокового перекрывания АО
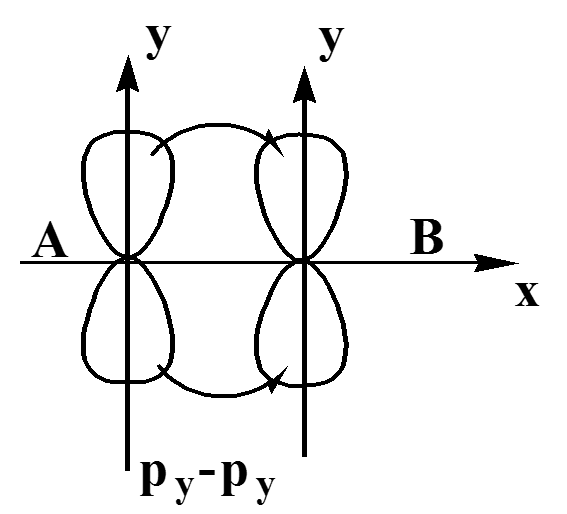
При боковом пере-крывании орбиталей образуется разно-видность ковалент-ной связи, называ-емая π- связью.
Чем сильнее пере-крываются орбита-ли, тем прочнее КС. Вот почему σ-связи прочнее π-связей.
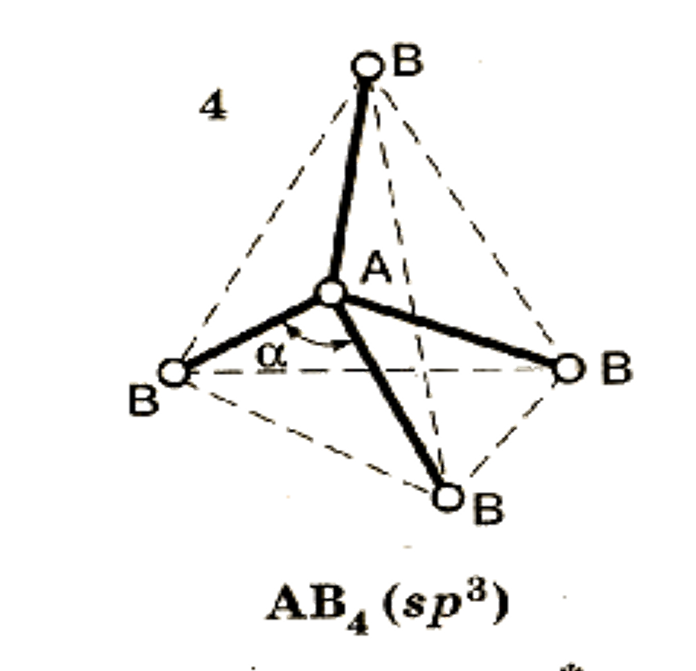
4. Если в молекуле три и более атомов, то орбитали ее центрального атома, как правило, гибри-дизованы.
Центральным является атом с наибольшей валентностью.
Гибридизация – вы-равнивание атом-ных орбиталей по форме и энергии в процессе образова-ния КС.
Гибридная AO

Гибридизация- энергетически выгод-ный процесс, обес-печивающий макси-мальное перекрыва-ние АО.
Тип гибридиза-ции определяет конфигурацию молекулы.
Конфигурация – пространствен-ное строение мо-лекулы.

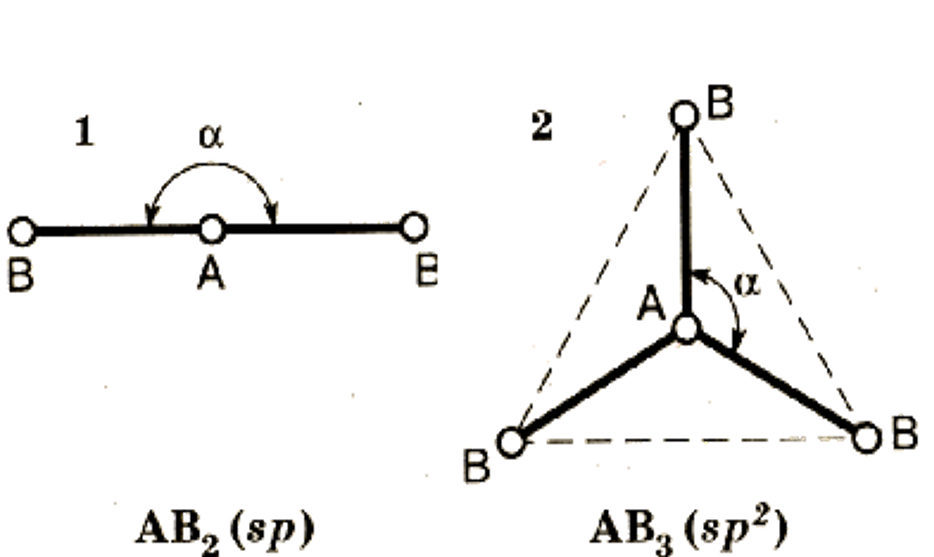
3
5
4
5.Ковалентная связь
Неполяр-ная
Полярная
Неполярные КС связывают атомы одного химическо-го элемента:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.