излучение частотой ![]() атом
водорода поглощать не будет.
атом
водорода поглощать не будет.
Задача 4.4. Определить наибольшую и наименьшую длины волн в ультрафиолетовой серии спектра водорода (серии Лаймана).
Решение:
Излучение атомом водорода квантов энергии происходит при переходе электрона с верхних энергетических уровней на нижние. При переходе электрона на первый уровень со всех вышестоящих образуются линии ультрафиолетовой серии (серии Лаймана). Длины волн соответствующих излучений вычисляются по сериальной формуле Бальмера (4.15), в которой номер серии n – это номер уровня, на который переходит электрон, а номер линии m – это номер уровня, с которого осуществляется переход.
Для ультрафиолетовой серии n = 1, m = 2, 3, …¥, и сериальная формула (5.1) будет иметь вид:

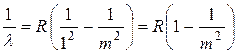 .
.
При m = 3 длина волны принимает свое максимальное значение, а при m = ¥ – минимальное:
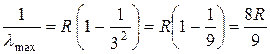 , где R = 1, 0,97∙107 м-1 – постоянная Ридберга, тогда
, где R = 1, 0,97∙107 м-1 – постоянная Ридберга, тогда
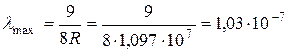 (м).
(м).
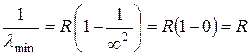
или
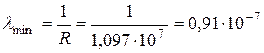 (м).
(м).
Действительно, на диаграмме энергетических уровней (рис. 4.3) изображены все возможные переходы электрона, дающие излучения ультрафиолетовой серии. Квант излучения, имеющий минимальную энергию и максимальную длину волны, образуется при переходе электрона со второго энергетического уровня на первый:
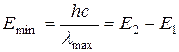 .
.
Квант с наибольшей энергией и наименьшей длиной волны излучается при переходе электрона с бесконечно удаленного уровня на первый:
 .
.
Ответ: в ультрафиолетовой серии излучения атома водорода λmin = 0,91∙10-7м, λmax = 1,03∙10-7м.
5. моменты атома
Задача 5.1. Найти максимальный орбитальный механический момент и максимальный полный магнитный момент атома азота.
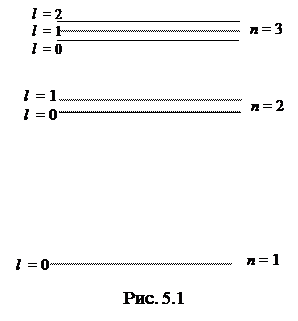 Решение:
Решение:
Электроны в атоме распределяются на электронные оболочки (уровни), которые
в свою очередь расщепляются на подуровни (рис. 5.1). Номера уровней
соответствуют главному квантовому числу n имеют
значения n = 1, 2, 3, … Расщепление уровней начинается
со второго, и число подуровней в оболочке равно n.
Номера подуровней соответствуют второму квантовому числу l – орбитальному – и могут принимать значения l = 0, 1, 2, 3… n – 1. Существует еще один
способ обозначения подуровней: подуровень l = 0
обозначают как s-подуровень, l = 1 – p-подуровень, l = 2 – d-подуровень, l = 3 – f-подуровень и т. д. Подчиняясь
принципу Паули, электроны заполняют подуровни по следующему правилу: максимальное
число электронов на s-подуровне – два, на p-подуровне – шесть, на d-подуровне –
десять. Всего в оболочке может разместиться 2n2 электронов. В основном состоянии (когда
атом невозбужден) электроны занимают все возможные состояния, начиная с нижнего
уровня, полностью заполняя все подуровни. И только самый верхний подуровень
может быть заполнен неполностью. Чтобы узнать количественно распределение
электронов по подуровням, надо записать электронную формулу атома. Атом азота имеет 7 электронов, и его электронная формула будет выглядеть
так: ![]() . В этой формуле большими цифрами обозначены номера уровней n, буквами – номера
подуровней l, маленькими цифрами – количество
электронов в подуровне.
. В этой формуле большими цифрами обозначены номера уровней n, буквами – номера
подуровней l, маленькими цифрами – количество
электронов в подуровне.
 Из электронной формулы следует, что электроны атома
азота распложены на двух оболочках (рис.5.2). Первая оболочка и s-подуровень второй оболочки полностью заполнены, p-подуровень
заполнен не полностью (не хватает трех электронов).
Из электронной формулы следует, что электроны атома
азота распложены на двух оболочках (рис.5.2). Первая оболочка и s-подуровень второй оболочки полностью заполнены, p-подуровень
заполнен не полностью (не хватает трех электронов).
Орбитальное движение электрона в атоме создает момент импульса или орбитальный механический момент, который квантуется по формуле:
|
|
(5.1) |
где l – орбитальное квантовое число.
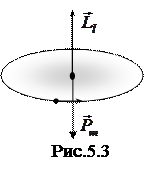 Направление вектора
Направление вектора ![]() определяется
направлением движения электрона (рис. 5.3). В полностью заполненных подуровнях
электроны движутся таким образом, что их моменты импульсов компенсируются.
Максимальное значение орбитального механического момента достигается в том
случае, если моменты всех трех электронов p-подуровня
сонаправлены. В этом случае результирующий орбитальный момент импульса будет
равен
определяется
направлением движения электрона (рис. 5.3). В полностью заполненных подуровнях
электроны движутся таким образом, что их моменты импульсов компенсируются.
Максимальное значение орбитального механического момента достигается в том
случае, если моменты всех трех электронов p-подуровня
сонаправлены. В этом случае результирующий орбитальный момент импульса будет
равен
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.