










1. Занятие №1
Тема: «Введение в титриметричсекий анализ».
2. Форма организации занятия: лабораторное занятие.
3. Значение темы: Титриметрический анализ (объемный) - часть аналитической химии, которая играет важную роль в биологии и медицине. Без знания состава различных сред организма невозможны ни понимание сущности живых организмов, ни понимание сущности процессов, протекающих в них, ни разработки научно обоснованных методов лечения. Диагностика многих заболеваний основана на сравнении результатов анализа данного больного с нормальным содержанием определенных компонентов крови, мочи, желудочного сока, других биологических жидкостей и тканей организма. Поэтому будущим врачам необходимо знать основные принципы и методы аналитической химии в частности принципы и методы количественного анализа.
4. План изучения темы:
4.1. Контроль исходного уровня знаний (устный опрос, тестовые задания согласно методическим рекомендациям для внеаудиторной работы студентов по данной теме)
4.2. Основные понятия и положения темы:
m (x) – масса вещества, г; n (х) – количество вещества, моль.
М (х) – молярная масса вещества, г/моль.
Молярная масса М (х) – это масса одного моль вещества, т.е.
![]()
Моль – это количество вещества, которое содержит столько структурных единиц (молекул, атомов, ионов, радикалов, электронов, а также условных единиц – эквивалентов), сколько атомов содержится в 12 г углерода (изотопа 12С).
Эквивалент – это условная (или реальная) частица, которая «передвигает» (отдает, принимает, замещает) один протон Н+ в кислотно-основных реакциях или один электрон е- в окислительно-восстановительных реакциях.
Существуют разные подходы к понятию «эквивалент», но самым удобным для практики, на наш взгляд, является подход через «условную частицу», чтобы можно было считать эти частицы и применять к ним понятие «количество эквивалентов вещества» и др.
Число протонов Н+ или электронов, которое «передвигается» одной реальной частицей вещества, называется эквивалентным числом и обозначается Z.
Понятно, что это число может относиться не к одной реальной частице, передвигающей протоны, а к одному моль таких частиц, передвигающих, соответственно, определенное количество моль протонов.
Эквивалентное число Z находят из уравнения реакции (или полуреакции) по стехиометрическим коэффициентам. Например, в реакциях:
H2SO4 + 2 NaOH = 2 H2O + Na2SO4 Z(H2SO4)=2, Z(NaOH)=1 (1)
H2SO4 + NaOH = H2O + NaHSO4 Z(H2SO4)=1, Z(NaOH)=1 (2)
В первом случае 1 моль H2SO4 отдает 2 моль Н+ (значит, число Z=2), а во втором случае 1 моль H2SO4 отдает 1 моль Н+(значит, число Z=1). Один моль щелочи в обоих случаях принимает 1 моль Н+. Заметим, что число Z, в общем случае, не является постоянным для данного соединения, а зависит от условий эксперимента.
Величина,
обратная Z, т.е. ![]() , называется фактором эквивалентности. Это безразмерная
величина, которая обозначается ƒэ .
, называется фактором эквивалентности. Это безразмерная
величина, которая обозначается ƒэ .
Понятно, что ƒэ также как и число Z, зависит от условий эксперимента. Фактор эквивалентности не превышает
1 (ƒэ= ![]() ≼1)
и показывает, какая доля реальной частицы «работает» с одним Н+.
А это, по определению, и есть эквивалент.
≼1)
и показывает, какая доля реальной частицы «работает» с одним Н+.
А это, по определению, и есть эквивалент.
Таким образом, в реакции (1) эквивалент H2SO4 : ƒэ (H2SO4) = ![]() (H2SO4) =
(H2SO4) =![]() , а в реакции (2) эквивалент H2SO4 : ƒэ
(H2SO4) =
, а в реакции (2) эквивалент H2SO4 : ƒэ
(H2SO4) = ![]() (H2SO4) = 1.
(H2SO4) = 1.
Зависимость
эквивалентного числа и фактора эквивалентности от условий эксперимента можно продемонстрировать и на примере окислительно-восстановительных
реакций. Так, эквивалент окислителя KMnO4 в кислой среде равен ![]() , в нейтральной среде –
, в нейтральной среде – ![]() , а в щелочной среде – 1. Это видно из соответствующих полуреакций
восстановления для окислителя
, а в щелочной среде – 1. Это видно из соответствующих полуреакций
восстановления для окислителя ![]() :
:
![]() Z(
Z(![]() =5
=5 ![]()
![]() Z(
Z(![]() =3
=3 ![]()
![]() Z(
Z(![]() =1
=1 ![]()
Формулы для расчета эквивалента кислот, оснований, солей в реакциях полного обмена:
![]()
![]()
![]()
Таким образом,мы выходим на новые понятия в химии:
n(![]() x) –
количество эквивалентов вещества, моль;
x) –
количество эквивалентов вещества, моль;
М(![]() x) – эквивалентная молярная масса вещества, или молярная масса
эквивалентов вещества, г/моль.
x) – эквивалентная молярная масса вещества, или молярная масса
эквивалентов вещества, г/моль.
Эквивалентная молярная масса – это масса одного моль эквивалентов вещества. Отсюда,
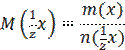
Взаимосвязь между показателями:
![]() ,
,![]()
Способы выражения концентрации растворов
C%(х) - процентная концентрация раствора, %.
Процентная концентрация – это масса растворённого вещества в 100 граммах раствора. Отсюда – формула:
![]() , %
, %
где
ρ – плотность раствора в г/мл, показывающая, сколько грамм весит 1 мл раствора:
ρ=![]() .
.
Рассматривая
формулу для ![]() как отношение массы компонента к массе всей
как отношение массы компонента к массе всей
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.