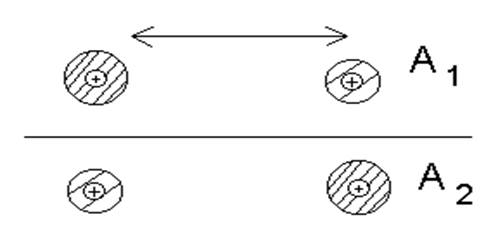
Если в этой задаче заменить протон на положительный ион лития, получим молекулярный ион LiH+ , который разлагается на свету. Это связано с тем, что в данном случае состояния A1, A2 становятся различимыми и энергии этих состояний даже при отсутствии переходов электрона с иона на протон - различны
![]() .
.
Это приводит к тому, что вероятность обнаружить электрон на протоне и ионе различна. Энергия связывающего и антисвязывающего состояний близки
 ,
,
что приводит к слабости химической связи, которая осуществляется одним электроном. Видно, что в связывающем состоянии электрон в основном локализован на ионе с более низкой энергией связи с электроном E1, а в антисвязывающем состоянии локализован на ионе с более высокой энергией связи. Это ионная связь, но слабая в силу того, что ее осуществляет только один электрон. Связь, осуществляемая двумя электронами описывается в следующем пункте.
Молекула водорода
При рассмотрении молекулы водорода имеем аналогичную ситуацию как выше. Обмен происходит электронами. В силу того, что состояния с двумя электронами на одном протоне маловероятны, имеем следующую картину состояний. При наличии переходов (при сближении протонов) эти состояния перестают быть состояниями с определенной энергией (стационарными). Переходы можно учесть, рассматривая амплитуду как суперпозицию амплитуд A1 и A2 , и вводя в гамильтониан дополнительное слагаемое, отвечающее за переходы электрона.
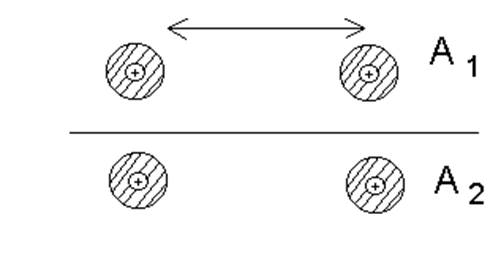
Амплитуды состояния с определенной энергией, отвечающие этому гамильтониану, являются суперпозициями амплитуд A1 и A2
 ,
,
Все формально совпадает с молекулярным ионом водорода, но связь становится сильнее, так как осуществляется двумя электронами. Эти электроны с антипараллельными спинами. Двух электронная связь значительно сильнее одноэлектронной даже для образования молекулы из различных атомов. Состояния A1 и A2 будут опять «неразличимыми» и их невозмущенные энергии будут одинаковыми и повторится картина аналогичная молекуле водорода, а не молекулярному иону LiH+. Это валентная связь. Если атомы различны и энергия притяжения электрона к одному из них значительно превосходит энергию притяжения к другому, оба электрона преимущественно локализованы на «сильном» атоме, который фактически становится отрицательным ионом, другой положительным ионом. Это ионная связь.
Молекулярно-орбитальное определение атомной валентности
В методе молекулярных орбиталей, линейной комбинации атомных орбиталей, электронная структура молекул описывается с помощью одноэлектронных волновых функций - молекулярных орбиталей, которые являются линейными комбинациями атомных волновых функций
![]() , где суммирование проводится по атомам А и В . Для
простоты ограничимся соединениями с замкнутыми электронными оболочками.
Молекулярная орбиталь (уровень энергии) заселена парой электронов с антипараллельными
спинами. Плотность вероятности
обнаружения электрона можно представить в виде
, где суммирование проводится по атомам А и В . Для
простоты ограничимся соединениями с замкнутыми электронными оболочками.
Молекулярная орбиталь (уровень энергии) заселена парой электронов с антипараллельными
спинами. Плотность вероятности
обнаружения электрона можно представить в виде
![]()
Величина ![]() - характеризует
распределение электронов между атомными орбиталями - электронные заселенности
орбиталей. Если просуммировать эти заселенности по атому получим долю
электронной плотности на атоме
- характеризует
распределение электронов между атомными орбиталями - электронные заселенности
орбиталей. Если просуммировать эти заселенности по атому получим долю
электронной плотности на атоме ![]() и заряд на атоме
и заряд на атоме ![]() (
(![]() -
заряд ядра). Эти величины - средние значения, могут быть нецелочисленными. В
методе МО валентность атома А определяется согласно
-
заряд ядра). Эти величины - средние значения, могут быть нецелочисленными. В
методе МО валентность атома А определяется согласно
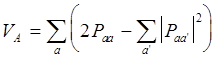 .
.
Распределение валентности атома по связям (кратность химической связи)
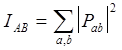 .
.
Валентность водорода, рассчитанная по методу МО изменяется от 0.95 в HF до 1.04 . Валентность углерода от VC=4.00 и ICC=0 в CH4 до VC=3.91 и ICC=0.99 в С3H6.
Литература
1. Р. Фейнман, Р. Лейтон, М. Сэндс. Фейнмановские лекции по физике. Т. 8,9. Мир,Москва (1978)
2. А. В. Тулуб, С.Г. Семенов. Валентность. Ленинград. (1989)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.