Найдем уравнение адиабатного процесса. Для этого запишем уравнение первого закона термодинамики (1.50) с учетом (1.21) при dq = 0:
![]()
Разделив первое уравнение на второе, после сокращения
на dT получим дифференциальное уравнение адиабаты ![]()
![]()
Используя
ранее введенное обозначение показателя адиабаты ![]() , после
разделения переменных и интегрирования имеем
, после
разделения переменных и интегрирования имеем
 , или
, или
![]()
Отсюда следует связь между параметрами состояния в адиабатном процессе
![]()
Соответственно уравнение адиабатного процесса для любых р и v, называемое адиабатой Пуассона, имеет вид
![]() (1.55)
(1.55)
Используя уравнение состояния
идеального газа (1.48), можно получить соотношения между параметрами состояния
в адиабатном процессе: ![]()
![]()

Из рис.1.2 следует, что кривая адиабатного процесса идет круче, чем изотерма, за счет показателя степени k > 1.
Удельная работа в равновесном адиабатном процессе производится только за счет изменения внутренней энергии газа и при сv = const равна:
![]()
Если подставить сv из (1.24), то получим другие формулы для расчета ls
![]()
или, с учетом уравнения состояния идеального газа (1.48):
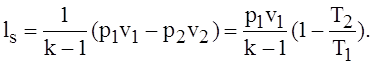 (1.56)
(1.56)
Используя соотношения параметров в адиабатном процессе, запишем еще два выражения для вычисления удельной работы адиабатного процесса:
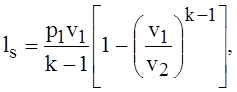
или 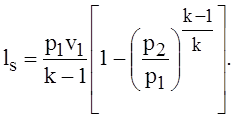 (1.57)
(1.57)
Выражения (1.56) и (1.57) получены при k=const. В случае, если коэффициент адиабаты зависит от температуры, то в практике расчетов используется его среднее значение:
![]()
По определению обратимого адиабатного процесса теплота qs = 0.
Изменение внутренней энергии обратимого адиабатного процесса ∆u = -ls, а изменение энтропии ∆s = 0. Изменение же энтальпии можно рассчитать по формуле (1.52):
![]() .
.
С помощью несложных преобразований можно найти связь между изменением энтальпии в адиабатном процессе и работой. Используя формулу (1.24), получаем
![]()
а с учетом ∆u = -ls получаем окончательно, что
![]()
1.9.5.Политропные процессы
Это обратимые термодинамические процессы, описываемые
уравнением ![]() с постоянным и произвольным значением показателя политропы n (
с постоянным и произвольным значением показателя политропы n (![]() ).
).
Политропный процесс является процессом, обобщающим все
рассмотренные выше процессы, т.е. n=0 соответствует изобарному
процессу, n=1 - изотермическому процессу, n = k -
адиабатному и n = ± ![]() -
изохорному процессам.
-
изохорному процессам.
Политропные процессы используются при анализе процессов в газовых двигателях, так как часто реальные процессы в них не являются ни адиабатными, ни изотермическими, а занимают промежуточное положение. Поэтому реальные значения n в этих случаях изменяются в пределах от 1 до k.
Уравнения связи для любых двух состояний газа в политропном процессе имеют вид
![]() или
или 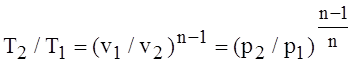 .
(1.58)
.
(1.58)
Обобщив адиабатный процесс (1.56), (1.57) на политропный, с учетом (1.58), запишем аналогичные уравнения для удельной работы:
 (1.59)
(1.59)
или
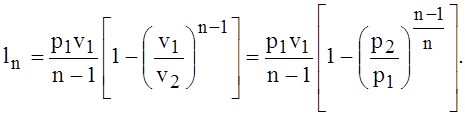 (1.60)
(1.60)
Теплоту политропного процесса можно определить, используя первый закон термодинамики в виде qn = ∆u + ln. Если обозначить через cn теплоемкость политропного процесса, то, приняв сn = const, его можно переписать таким образом:
![]()
Отсюда теплоемкость политропного процесса
![]() .
.
и, следовательно, теплота процесса
![]() .
.
1.10.Адиабатное истечение газов и паров из сопел
Соплом называется канал, специально спрофилированный для увеличения скорости газов до заданного значения и в заданном направлении. Сопла имеют суживающийся или комбинированный профиль.
Рассмотрим случай обратимого адиабатного истечения газа из неограниченного сосуда через суживающееся сопло. Из-за большой скорости протекания процесса истечения газ не успевает обмениваться теплотой с внешней средой, и поэтому q = 0.
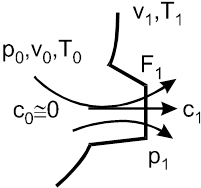 |
При принятых условиях имеем III частный случай первого закона термодинамики для потока и из уравнения (1.18) получим формулу теоретической скорости адиабатного истечения газа на выходе из сопла
![]() , м/с.
(1.61)
, м/с.
(1.61)
Обычно с0<<с1t, поэтому (1.61) упрощается:
![]() , м/с. (1.62)
, м/с. (1.62)
Здесь уменьшение энтальпии H0с =h0 – h1t, Дж/кг называется располагаемым теплоперепадом сопла.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.