






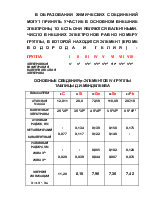

ПЕРИОДИЧЕСКИЙ ЗАКОН Д.И.МЕНДЕЛЕЕВА
I. СВОЙСТВА ПРОСТЫХ ТЕЛ, А ТАКЖЕ ФОРМЫ И СВОЙСТВА СОЕДИНЕНИЙ ЭЛЕМЕНТОВ НАХОДЯТСЯ В ПЕРИОДИЧЕСКОЙ ЗАВИСИМОСТИ ОТ ВЕЛИЧИНЫ АТОМНЫХ ВЕСОВ ЭЛЕМЕНТОВ.
II. СВОЙСТВА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ОБРАЗУЕМЫХ ИМИ ПРОСТЫХ И СЛОЖНЫХ ВЕЩЕСТВ НАХОДЯТСЯ В ПЕРИОДИЧЕСКОЙ ЗАВИСИМОСТИ ОТ ЗАРЯДА ЯДРА ИХ АТОМОВ.
ХИМИЧЕСКИЙ ЭЛЕМЕНТ – ЭТО СОВОКУПНОСТЬ АТОМОВ С ОДИНАКОВЫМ ЗАРЯДОМ ЯДРА.
НОСИТЕЛЕМ ПОЛОЖИТЕЛЬНОГО ЗАРЯДА ЯДРА ЯВЛЯЮТСЯ ПРОТОНЫ. ИХ ЧИСЛО ОПРЕДЕЛЯЕТ ВЕЛИЧИНУ ЗАРЯДА ЯДРАИ, СЛЕДОВАТЕЛЬНО,АТОМНЫЙ (ПОРЯДКОВЫЙ) НОМЕР ХИМИЧЕСКОГО ЭЛЕМЕНТА.
ОСНОВНЫЕ ЧАСТИЦЫ АТОМА – ПРОТОН (Р), НЕЙТРОН (n) И ЭЛЕКТРОН (е). МАССА ЭЛЕКТРОНА В 1840 РАЗ МЕНЬШЕ МАСЫ ПРОТОНА И НЕЙТРОНА. ТАКИМ ОБРАЗОМ, МАССА АТОМА ПРАКТИЧЕСКИ РАВНА МАССЕ ЯДРА – СУММЕ МАСС ПРОТОНОВ И НЕЙТРОНОВ (НУКЛОНОВ).
ВАЖНОЙ ХАРАКТЕРИСТИКОЙ ЯДРА ЯВЛЯЕТСЯ МАССОВОЕ ЧИСЛО (А), КОТОРОЕ РАВНО ОБЩЕМУ ЧИСЛУ ПРОТОНОВ (Р) И НЕЙТРОНОВ (n), ВХОДЯЩИХ В ЯДРО :
А = Р + n ИЛИ А = Z + N
РАЗНОВИДНОСТИ ОДНОГО И ТОГО ЖЕ ХИМИЧЕСКОГО ЭЛЕМЕНТА, ОТЛИЧАЮЩИЕСЯ МАССОЙ АТОМОВ, НАЗЫВАЮТ ИЗОТОПОМ.
ЯДРА АТОМОВ ИЗОТОПОВ РАЗЛИЧАЮТСЯ ЧИСЛОМ НЕЙТРОНОВ. ТАК, ИЗОТОПАМИ КАЛЬЦИЯ (Са) ЯВЛЯЮТСЯ :
4020Са (20 р, 20 n);
4220Са (20 р, 22 n);
4320Са (20 р, 23 n).
Li Be B C N O F Ne
Na Mg Al Si P S Cl ArИТ.П
ОСНОВНОЙ СТРУКТУРНОЙ ЕДИНИЦЕЙ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ЯВЛЯЕТСЯ ПЕРИОД.
ПЕРИОДОМ С НОМЕРОМ n НАЗЫВАЮТ СОВОКУПНОСТЬ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ, РАСПОЛОЖЕННЫХ В ПОРЯДКЕ ВОЗРАСТАНИЯ ЗАРЯДАЯДРА АТОМА, КОТОРАЯ НАЧИНАЕТСЯ С ns-ЭЛЕМЕНТАМИ И ЗАКАНЧИВАЕТСЯ nр – ЭЛЕМЕНТАМИ.
ВАЛЕНТНОСТЬ И СТЕПЕНЬ ОКИСЛЕНИЯ
ВАЛЕНТНОСТЬ- ЭТО ЧИСЛО ХИМИЧЕСКИХ СВЯЗЕЙ, ОБРАЗОВАННЫХ ДАННЫМ АТОМОМ В СОЕДИНЕНИИ. ОДНИМ СЛОВОМ, СПОСОБНОСТЬ АТОМОВ К ОБРАЗОВАНИЮ ХИМИЧЕСКИХ СВЯЗЕЙ ХАРАКТЕРИЗУЕТ ВАЛЕНТНОСТЬ.
ПОД ЧИСЛОМ ХИМИЧЕСКИХ СВЯЗЕЙ ПОДРАЗУМЕВАЮТ ЧИСЛО ОБЩИХ ПАР ЭЛЕКТРОНОВ. СЛЕДОВАТЕЛЬНО, ПОНЯТИЕ ВАЛЕНТНОСТИ ПРИМЕНИМО ТОЛЬКО К СОЕДИНЕНИЯМ С КОВАЛЕНТНЫМ ТИПОМ СВЯЗИ ИЛИ К МОЛЕКУЛАМ В ГАЗОВОЙ ФАЗЕ. В КРИСТАЛЛАХ ИОННЫХ СОЕДИНЕНИЙ И МЕТАЛЛОВ ОБЩИХ ПАР ЭЛЕКТРОНОВ НЕТ, ПОЭТОМУ ПОНЯТИЕ ВАЛЕНТНОСТИ НЕ ИМЕЕТ СМЫСЛА.
СОВРЕМЕННОЕ ПРЕДСТАВЛЕНИЕ О ПРИРОДЕ ХИМИЧЕСКОЙ СВЯЗИ ОСНОВАНО НА ЭЛЕКТРОННОЙ (СПИНОВОЙ) ТЕОРИИ ВАЛЕНТНОСТИ, СОГЛАСНО КОТОРОЙ АТОМЫ, ОБРАЗУЯ СВЯЗИ, СТРЕМЯТСЯ К ДОСТИЖЕНИЮ НАИБОЛЕЕ УСТОЙЧИВОЙ ЭЛЕКТРОННОЙ КОНФИГУРАЦИИ. ЭЛЕКТРОНЫ, ПРИНИМАЮЩИЕ УЧАСТИЕ В ОБРАЗОВАНИИ ХИМИЧЕСКИХ СВЯЗЕЙ, НАЗЫВАЮТСЯ ВАЛЕНТНЫМИ.
ВАЛЕНТНОСТЬ АТОМА ОПРЕДЕЛЯЕТСЯ ЧИСЛОМ ЕГО НЕСПАРЕННЫХ ЭЛЕКТРОНОВ, СПОСОБНЫХ УЧАСТВОВАТЬ В ОБРАЗОВАНИИ ХИМИЧЕСКИХ СВЯЗЕЙ.
СТЕПЕНЬ ОКИСЛЕНИЯ – ЭТО ПОЛОЖИТЕЛЬНОЕ ИЛИ ОТРИЦАТЕЛЬНОЕ ЧИСЛО, КОТОРОЕ ПРИСВАИВАЮТ ЭЛЕМЕНТУ В СОЕДИНЕНИИ. ФИЗИЧЕСКОГО СМЫСЛА СТЕПЕНЬ ОКИСЛЕНИЯ НЕ ИМЕЕТ,ОНА ЛИШЬ ДАЕТ КОЛИЧЕСТВЕННУЮ ОЦЕНКУ СОСТОЯНИЯ АТОМА В СОЕДИНЕНИИ. ТАК, ОБЫЧНАЯ СТЕПЕНЬ ОКИСЛЕНИЯ ВОДОРОДА РАВНА +1, А КИСЛОРОДА -2.
ЗНАК СТЕПЕНИ ОКИСЛЕНИЯЗАВИСИТ ОТ ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ ОБРАЗУЮЩИХ СОЕДИНЕНИЕ ЭЛЕМЕНТОВ.
НАПРИМЕР, РАССМОТРИМ СОЕДИНЕНИЯ NH3 И NF3. В СООТВЕТСТВИИ С РАЗЛИЧИЕМ В ЭЛЕКТРООТРИЦАТЕЛЬНОСТЯХ АЗОТАN (3,0), ФТОРАF (4,0) И ВОДОРОДА H (2,1) АЗОТУ В NH3 ПРИПИСЫВАЕТСЯ ОТРИЦАТЕЛЬНАЯ СТЕПЕНЬ ОКИСЛЕНИЯ -3 , А ВNF3 – ПОЛОЖИТЕЛЬНАЯ СТЕПЕНЬ ОКИСЛЕНИЯ +3.
ПРИ ПОЛЬЗОВАНИИ СТЕПЕНЯМИ ОКИСЛЕНИЯ НЕОБХОДИМО ЗНАТЬ :
1. СУММА СТЕПЕНЕЙ ОКИСЛЕНИЯ АТОМОВ В ЛЮБОЙ ЧАСТИЦЕ РАВНА ЕЕ ЭЛЕКТРИЧЕСКОМУ ЗАРЯДУ. СЛЕДОВАТЕЛЬНО, СТЕПЕНЬ ОКИСЛЕНИЯ ЭЛЕМЕНТА В ЕГО ПРОСТОМ ВЕЩЕСТВЕ РАВНА НУЛЮ.
2. В СОЕДИНЕНИИ С ДРУГИМИ ЭЛЕМЕНТАМИ ФТОР ЧАЩЕ ВСЕГО ПРОЯВЛЯЕТ СТЕПЕНЬ ОКИСЛЕНИЯ
-1.
3. СТЕПЕНЬ ОКИСЛЕНИЯ ВОДОРОДА ЧАЩЕ +1 И РЕЖЕ
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.