Министерство образования и науки
Российской Федерации
Российский Государственный Университет нефти и газа
им. И. М. Губкина
Кафедра органической химии и химии нефти
КУРСОВАЯ РАБОТА
в практикуме по синтетическим методам органической химии
( Литературный синтез)
на тему:
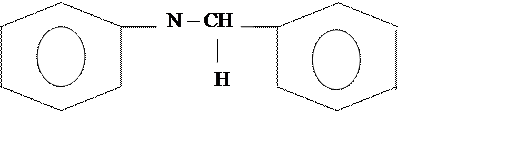
«Бензальанилин»
Студент: Преподаватель:
Группа: ХТ-05-1
Москва 2007
Содержание.. 2
1.Введение. 3
2.Теоретическая часть.. 4
2.1Название и структурная формула вещества. 4
2.2Физические свойства: 4
2.3Химические свойства: 5
2.4.Обоснование выбора методики. 8
3.Экспериментальная часть: 9
3.1.Первая стадия синтеза. 9
3.2.Вторая стадия. 12
Выводы... 14
Использованная литература.. 15
Литературный синтез является заключительной работой в практикуме по синтетическим методам органической химии. Цель данной работы – применить на практике все теоретические знания по курсу органической химии, а также показать навыки работы с различными приборами.
Целью литературного синтеза является получение и изучение свойств бензальанилин. Органический синтез – это получение вещества заданного строения путем целенаправленного изучения структуры исходных соединений.
При получении любого органического соединения возможны два случая: необходимый препарат уже известен, для него разработаны и описаны в литературе методы получения, либо необходимое вещество не описано. В первом случае задача сводится к описанию всех известных методик синтеза и выбору оптимальной. Наиболее применимым является метод, предполагающий использование доступного сырья с наименьшими энергетическими и трудовыми затратами. Особенностью взаимодействия органических веществ является возможность протекания многочисленных побочных реакций. Образующие смеси иногда трудно разделить. Это приводит к тому, что преимущества метода получения заданного препарата может быть сведены на нет трудностью его выполнения и очистки. В этих случаях, если это возможно, предпочтительнее многостадийный синтез более сложный, но дающий возможность получить относительно чистый препарат или же смесь веществ, резко отличаются по температурам кипения или растворимости, что позволяет легко растворить его.
бензальанилин
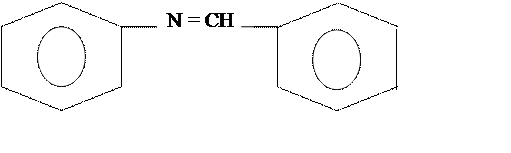
Брутто формула: C6H5NCHC6H5
Бензальанилин, молекулярная масса 181 г/моль, кристаллы желтовато-белого цвета, Тпл=520С, плотность d=0,901 г/см3. Внешне похожи на пенопласт.
Бензальанилин в своём строении имеет бензольное кольцо и двойную связь. На основании этого рассмотрим его химические свойства.
Реакция окисления:
Идет по двойной связи с образованием нитробензола и бензойной кислоты
|
|
 |
 |
![]() +
+
Реакция восстановления:
В результате образуется анилин и толуол
|
 |
 |
||||||
|
|||||||
+
Эта реакция является методом гидроочистки. При дальнейшем гидрировании идет выделение аммиака.
Реакция присоединения по двойной связи
Образуется соль

|
|
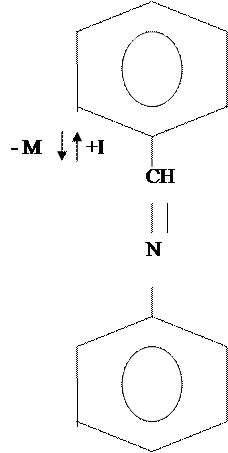
Реакции по бензольному кольцу
Присоединение к бензольному кольцу пойдет в мета положение
 |
|||
 |
|||
![]()
|
 |
|||
По этому механизму будут проходить реакции нитрования, сульфирования, галогенирования, ацилирования.
При избытке присоединение пойдет в мета положение к другому бензольному кольцу.
Данное мне вещество можно синтезировать только реакцией конденсации. В литературе чаще всего бензальанилин получают из анилина и бензальдегида. Для выполнения этого синтеза я выбрал методику из Птициной О.А. Так как по ней синтез проводится довольно быстро (40 – 50мин) и она не требует сборки какой либо установки, вся реакция проводится в стакане 100мл при постоянном помешивании стеклянной палочкой. Наиболее сложной в моей работе была первая стадия, получения анилина. По совету преподавателя я выбрал методику приведенную в Храмкиной М.Н. Так как, в отличии от других, по этой методике синтез проводят с использованием олова (при использовании железа на посуде образуется не отмывающийся красно-оранжевый налет). Исходных веществ, для получения продукта, необходимо гораздо меньше, чем в других предложенных методиках.
По методике (Птицина с.218-219) для получения 15г. бензальанилина берут: 10 мл бензальдегида;
9 мл анилина.
Мне для получения 10г. необходимо:
бензальдегида 6.67 мл анилина 6 мл
Анилина для II стадии необходимо 6мл или 0,066моль. Значит в I стадии необходимо получить 0,066 ∙ 1,3 = 0,0858моль или
6,13 ∙ 1,3 = 8г.
Получение анилина.[8г]
Уравнения реакций:
2C6H5NO2 + 3Sn + 14HCl = 2С6Н5NH2 ∙ HCl + 3SnСl4 + 4H2O;
С6Н5NH2 ∙ HCl + NaOH = С6Н5NH2 + NaCl + H2O
Расчет количеств исходных веществ по уравнению реакции:
ν(C6H5NH2) = 0,0858моль нитробензол ν(C6H5NH2) = ν(C6H5NО2) = 0,0858моль
m(C6H5NО2) = 10,578г олово (гранулированное) ν(Sn) = 0,1287моль
m(Sn) = 15,31г соляная кислота ν(HCl) = 0,6006моль
m(HCl) = 21,9г гидроксид натрия ν(NaOH) = 0,0858моль
m(NaOH) = 3,44г
Расчет количеств исходных веществ по практикуму:
По методике Храмкина М.Н. с.207-208
|
Вещества |
12г |
8г |
|
нитробензол |
15мл |
10мл |
|
олово |
36г |
24г |
|
соляная кислота |
80мл |
53,3мл |
|
гидроксид натрия |
45г |
30г |
Таблица 1 Характеристика и свойства веществ.
|
Название реактивов |
Брутто формула |
Мол масса |
Основные константы |
Количества исходных веществ |
|||||||
|
Ткип оС |
Тпл оС |
d204 г/см3 |
По ур-ю реакции |
По методике |
Избы ток |
||||||
|
г |
Моль |
г |
моль |
мл |
|||||||
|
Ниторбензол |
С6Н5NO2 |
123 |
1,2 |
10,58 |
0,0858 |
12 |
0,097 |
10 |
0,0112 |
||
|
Соляная кислота |
HCl |
36,5 |
–— |
–— |
1,19 |
21,9 |
0,6 |
63,4 |
1,74 |
53,3 |
1,14 |
|
Олово |
Sn |
119 |
___ |
___ |
_____ |
15,31 |
0,128 |
24 |
0,2 |
___ |
0,072 |
|
Гидроксид натрия |
NaON |
40 |
1378 |
320 |
2,13 |
3,44 |
0,0858 |
30 |
0,75 |
14,1 |
0,6642 |
Описание синтеза
Собрали прибор, состоящий из двугорлой круглодонной колбы объёмом 500 мл, капельной воронки, обратного воздушного холодильника, колбогрейки. В круглодонную колбу помещаем 10мл нитробензола, 24г гранулированного олова, затем по каплям приливаем 53,3 мл соляной кислоты. После прибавления каждой порции колбу встряхиваем. Колбогрейкой поддерживаем слабое кипение. После введения всей кислоты добавляем раствор 30г гидроксида натрия в 30 мл воды, чтобы избавится от избытка соляной кислоты и разложить. Выделившийся анилин отгоняют с водяным паром.
Сушат гидроксидом калия, отгоняют с водяным холодильником
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.