взятое в реакцию сырьё является отношение количества фактически полученного целевого продукта к количеству целевого продукта, которое можно получить в соответствии со стехиометрическими коэффициентами при 100-ой % конверсии сырья. Такие расчёты выполняются для необратимых реакций.
Селективностью процесса по данному целевому продукту называется отношение количества фактически полученного продукта к тому количеству целевого продукта, которое можно получить из прореагировавшего в реакции сырья, исходя из стехиометрических соотношений.
Селективность для реакции типа :
Основные тенденции и перспективы развития современной химической промышленности
- Повышение селективности процессов
- Экономия сырья и его комплексное использование
- Повышение качества химической продукции
Сырьё химической промышленности
Роль сырья и энергии в химической промышленности
Себестоимость продукции химической промышленности, % :
амортизация
другие расходы
3-4
2-7
5
заработная плата
15-25
60-70
топливо и энергия
сырьё
Классификация сырья и области его использования
Сырьё для органического синтеза
Минеральное
Воздух
Животное
Растительное - биомасса
Вода
рудное
нерудное
органическое
твердое (уголь)
жидкое (нефть)
газообразное (газ)
Выбор сырья для основного (тяжёлого) органического синтеза (ТОС)
Четыре источника органического сырья
Нефть (включая газовый конденсат)
Уголь и горючие сланцы
Природный и попутный нефтяной газ
Биомасса растительного происхождения
Основополагающие критерии выбора сырья:
1. Ресурсы сырья данного вида
2. Потребности промышленности в данном виде сырья
3. Стоимость (цена) сырья
Следует принимать во внимание:
1. Мировые тенденции в эволюции сырьевой базы и
существующих технологий
2. Экологические проблемы
Нефть
1. Ресурсы:
- является основным сырьевым источником;
- достоверные мировые запасы 145 млрд.т (на начало века);
- 12-13 % мировых запасов приходится на долю России;
- объем мировой добычи 3,5 млрд.т;
- 13 % мировой добычи приходится на долю РФ (470 млн. т);
- переработка нефтяного сырья в РФ – 205 млн. т/год;
Нефть
2. Потребности:
- расход нефти в промышленности НХС в мире около 9 %;
- в РФ свыше 80 % всего у/в сырья для нефтехимической промышленности поступает с НПЗ;
- нефтехимия в РФ использует 2,5 % от объема переработанной нефти;
3. Цена:
- верхний предел цены составляют издержки массового рентабельного производства СЖТ из угля, нефтеносных сланцев, природного газа плюс нормальная прибыль;
- нижний предел составляют издержки на добычу нефти в наиболее труднодоступных районах (шельфы Северного и Баренцева морей) плюс нормальная прибыль;
Уголь
1. Ресурсы:
- запасы угля в мире превышают запасы нефти и газа;
- доступные мировые запасы 480 млрд. т.н.э (тонн нефтяного эквивалента);
- суммарные запасы нефти и газа 270 млрд. т.н.э ;
- 12 % мировых разведанных запасов приходится на долю РФ;
2. Потребности:
- для получения 1т этилена необходимо переработать 30 т угля;
3. Цена:
- 30 - 40 $/т;
Природный и попутный нефтяные газы
1. Ресурсы:
- возрастает роль природного газа, как химического сырья;
- доказанные мировые запасы 146 трлн. м3;
- 38 % мировых запасов приходится на долю РФ;
- разведанные запасы в РФ 48 трлн. м3;
- добыча в России в 2005 г. составила 640 млрд. м3;
2. Потребности:
- в РФ химическая промышленность потребляет 2,0-2,5 % объема добычи;
3. Цена:
- на границе с Западной Европой около 200$/1000 м3;
Биомасса
1. Ресурсы:
- ежегодно на планете образуется на суше и водоёмах 150-200 млрд.т. (на сухое вещество);
- 0,1 часть биомассы эквивалентна 6-8 млрд. т. нефти;
2. Потребности:
- человечество использует для своих нужд не более 8-10 %;
3. Цена:
- зависит от региона и вида биомассы
Важнейшие тенденции в развитии сырьевой проблемы:
- Изыскание и применение более дешёвых и менее дефицитных видов сырья;
- Экономия сырья и его комплексное использование;
- Применение концентрированного сырья и возможность промышленной переработки используемых отходов;
- Возможность максимального использования местных видов сырья и сокращение объема перевозок
Энергопотребление в химической промышленности
Структура потребления энергии в химической промышленности в РФ, % :
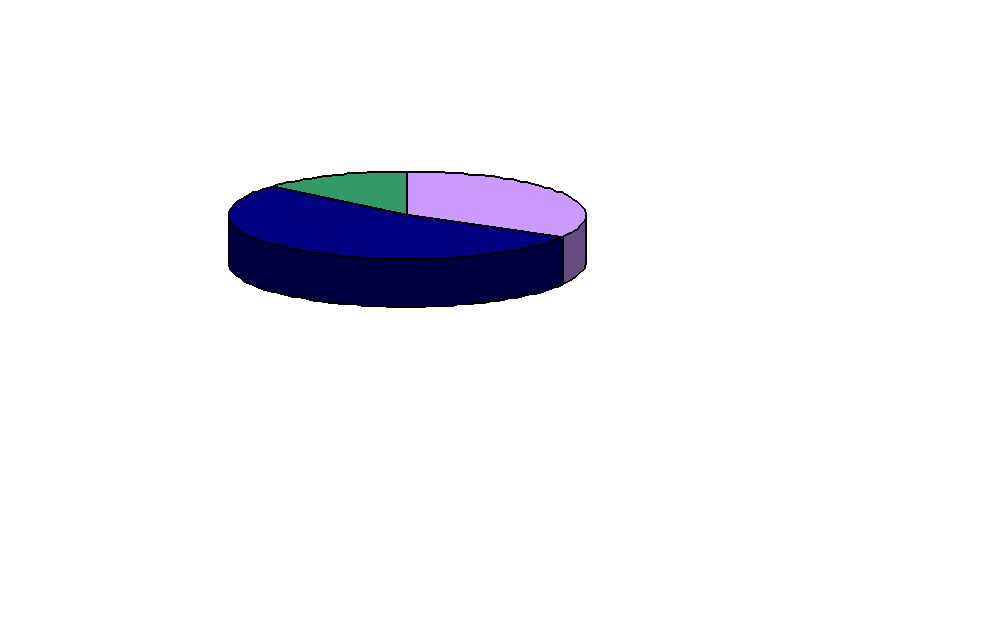
33,4 %
13,7 %
Электрическая
Топливо прямого использования
52,9 %
Тепловая (пар и горячая вода)
Основные принципы энергосберегающей технологии в химических производствах:
- совершенствование технологии;
- улучшение использования энергии;
- организация энергосберегающей политики.
Критерий экономического использования энергии
nэ – коэффициент использования энергии; Wт – количество энергии, которое теоретически требуется затратить на получение массовой (или объемной) единицы продукта; Wпр – количество практически затраченной энергии.
Степень использования тепла
nт – тепловой КПД; Qт – количество тепла, использованного непосредственно на осуществление основных химических реакций; Qпр – общее количество затраченного тепла.
Организация энергосберегающей политики:
- создание энерго-технологических схем;
- учёт всех видов энергии на установке;
- поддержание эффективности работы оборудования (чистота, герметичность, исправность);
- уменьшение до минимума коэффициента избытка воздуха в печах и количества газов, сбрасываемых на факел;
- поддержание оптимального режима работы.
Вторичные энергоресурсы (ВЭР) – это энергетический потенциал продукции, отходов, побочных и промежуточных продуктов, образующихся в технологической установке, который может быть частично или полностью использован для энергосбережения других потребителей
ВЭР
Механические (энергия сжатых газов)
Горючие (используемые как топливо)
Тепловые (используемые как источник физического тепла)
Вода как сырьё и вспомогательный компонент химического производства
Вода:
- сырье
- реагент
- растворитель
- теплоноситель
- охлаждающий агент
- и др.
Требования к качеству воды
Основные показатели качества воды:
- жесткость;
- общее солесодержание;
- окисляемость;
- прозрачность;
- цвет;
- запах;
- реакция.
Жесткость
Жесткость – это свойство воды, обусловленное присутствием в ней растворимых солей кальция и магния
Временная жесткость вызывается бикарбонатами кальция и магния Ca(HCO3)2 и Mg(HCO3)2. При кипячении – разлагаются.
Постоянная жесткость вызывается хлоридами, сульфатами и нитратами кальция и магния. При кипячении – не удаляются.
Общее солесодержание или сухой остаток – характеризует наличие в воде минеральных и органических примесей (мг/1 л воды) после испарения воды и высушивания полученного остатка
Окисляемость это свойство воды, обусловленное наличием в ней органических веществ. Определяется числом мг перманганата калия, израсходованного при кипячении 1 л воды
Прозрачность измеряется толщиной слоя, через который можно различить визуально или с помощью фотоэлемента изображение креста или определенного шрифта
Реакция это кислотность или щелочность воды. Характеризуется концентрацией водородных ионов или величиной рН
Промышленная водоподготовка
1. осветление;
2. обеззараживание;
3. умягчение;
4. дегазация.
Осветление воды
- От взвешенных примесей воду очищают отстаиванием и фильтрацией – через слой песка, гравия и т.п.
- Для осаждения коллоидных примесей в отстойники вводят коагулянты – сульфаты железа или алюминия
Обеззараживание воды
- Удаление из воды микроорганизмов и бактерий путем хлорирования и озонирования
Для хлорирования используют хлор, гипохлорит кальция и др.
Дегазация воды
- Удаление из воды растворенных в ней вредных газов (сероводорода, диоксидов серы и углерода)
Умягчение воды
- Полное или частичное удаление солей кальция и магния
Известково-содовый способ
Фосфатный способ
Ионообменные способы
Ионообменные смолы – иониты (катиониты и аниониты)
Катионный обмен:
Анионный обмен:
Химико-технологические системы
Общее понятие о системах и ХТС
Система – это сложный объект, состоящий из взаимосвязанных и взаимодействующих между собой и с внешней средой элементов или подсистем
Элемент – самостоятельная и условно неделимая единица. В ХТ – это аппарат, в котором протекает какой-либо типовой процесс (химический, тепловой и т.п.)
Подсистема – группа элементов (агрегат), обладающая определенной целостностью и целенаправ- ленностью. Это самостоятельно функционирующая часть системы
Химико-технологическая система (ХТС) – это совокупность физико-химических процессов, происходящих в системе и средств для их реализации
ХТС включает в себя:
- химический процесс, протекающий в системе;
- аппараты, в которых этот процесс протекает;
- средства контроля и управления процессом;
- связи (коммуникации) между элементами системы.
Химическое предприятие как сложная система
Характерные признаки ХТС:
1. Существование общей цели функционирования;
2. Большие размеры системы;
3. Большое число параметров, характеризующих работу системы;
4. Сложность поведения системы;
5. Высокая степень автоматизации процессов управления;
6. Необходимость создания потоков осведомительной и управляющей информации между элементами ХТС и управляющими устройствами.
Иерархическая структура химического производства
IV
III
II -1
II -N
II -2
Производство водорода и азотоводородной смеси
Сырьё и промышленные способы получения водорода
Промышленные способы получения водорода :
1) паровая каталитическая конверсия легких у/в с подводом тепла;
2) автотермическая каталитическая конверсия легких у/в;
3) высокотемпературная кислородная конверсия у/в сырья;
4) кислородная или парокислородная газификация твердого топлива;
5) конверсия биомассы растительного сырья с водой;
6) электролиз воды и растворов солей;
7) извлечение водорода нефтепереработки, нефтехимии и коксохимии.
Производство водорода и азотоводородной смеси конверсией легких углеводородов
Природный газ
Обессеривание
Водяной пар
I ступень
Паровая конверсия
Получение азотоводородной смеси
Получение водорода
Синтез-газ (CO + H2)
Автотермическая конверсия метана
Конверсия оксида углерода
II ступень
III ступень
Конверсия оксида углерода
Абсорбция ди- оксида углерода
Абсорбция диоксида углерода
Адсорбция CO и CO2
Каталитическое гидрирование
Каталитическое гидрирование
Азотоводородная смесь
Водород
Обессеривание
Каталитическая парокислородовоздушная конверсия
Термодинамические основы процесса
Конверсию у/в газов (CH4) для получения водорода ведут , применяя в качестве окислителя водяной пар или кислород
Выбор условий проведения процессов
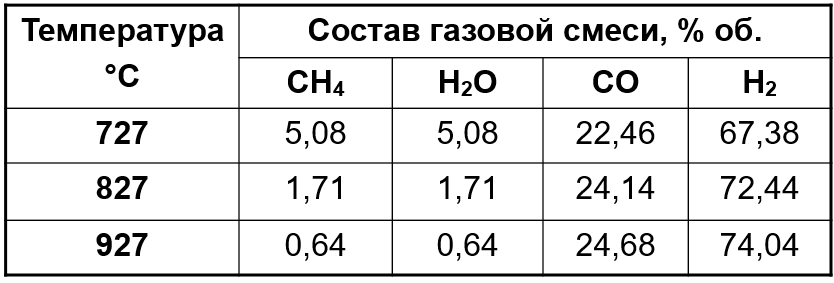
- применяют повышенные (до 4 МПа) давления;
- катализаторы в качестве активного компонента содержат никель, нанесенный на оксид алюминия и оксид магния;
- конверсия легких у/в протекает при Т=760-900 °С;
Конверсия оксида углерода
В РФ сегодня используются катализаторы 2-х типов: а) высокотемпературные катализатор на основе оксида железа с добавлением оксидов хрома (СТК-1); При Т=320-470 °С содержание СО в газовой смеси 2-4%
б) низкотемпературные цинк-хромовомедные и цинк-хром- медноалюминиевые катализаторы; При Т=190-250 °С содержание СО в газовой смеси 0,2-0,4%
Технологическая схема производства водорода конверсией легких углеводородов
I
VI
V
2
8
9
3
1
4
5
6
14
10
IV
II
III
11
13
II
16
7
15
II
12
V
Потоки: I - природный газ; II – водяной пар; III – воздух; IV – контактный газ; V – вода; VI – кислород.
Абсорбция СО2
Очистка водными растворами этаноламинов
- абсорбция протекает при Т=40-45 °С и Р=1,5-3,0 МПа;
- содержание CO2 в очищенном газе – 0,01-0,1 % масс.;
Поташная очистка – очистка растворами карбонатов
- Т=110-120 °С и Р=2,0-3,0 МПа;
- содержание CO2 в очищенном газе – 0,05-0,1 % масс.;
Очистка холодным метанолом «Ректизол-процесс»
- условия процесса: Т= -60 °С и Р=0,4 МПа;
Тонкая очистка методом метанирования
Реакции метанирования (метанизации)
- условия процесса: Р=0,4 МПа; Т= 300-350 °С (с кат. типа Fe) и 200 °С (с кат. типа Ni-Cr или Ni-AI);
Очистка методом PSA (КЦА) (короткоцикловая адсорбция)
- процесс PSA – получение водорода с чистотой 99,5-99,999% об.
- очистка осуществляется на молекулярных ситах при переменном давлении.
- циклы адсорбции примесей и десорбции чередуются
Производство аммиака
Теоретические основы синтеза аммиака
- синтез ведут при Т не ниже 400-500 °С и в присутствии твердых катализаторов (Fe, Mo, Mn, W)
- в РФ используется губчатый железный катализатор, содержащий 4 промотора: Al2O3, K2O, CaO, SiO2
- H2S и другие серу содержащие соединения отравляют железный катализатор необратимо, кислород и его соединения (H2O, CO, CO2) - обратимо
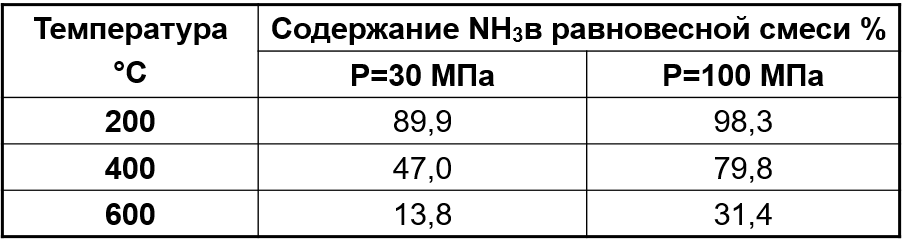
Зависимость содержания аммиака в равновесной смеси от давления и температуры
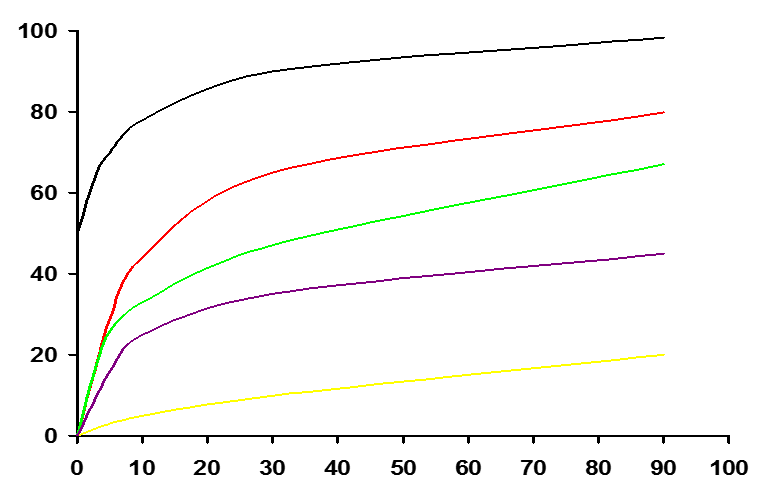
200 °С
Содержание NH3 в равновесной смеси, % об.
300 °С
400 °С
500 °С
700 °С
Р, МПа
Синтез аммиака – это гетерогенно-каталитический процесс, протекающий через ряд стадий:
1. Диффузия азота и водорода из газового объема к поверхности катализатора и внутри пор зерна;
2. Активированная (химическая) адсорбция газов на кат.;
4. Десорбция аммиака и его диффузия в объем газовой фазы
Уравнение М.И. Темкина
U – скорость процесса на промышленных железных катализаторах; K1 – константа скорости синтеза аммиака; K2 – константа скорости разложения аммиака; Pi – парциальные давления компонентов.
Роль объемной скорости и производительности катализатора в процессе
W – объемная скорость газовой смеси; Т – время нахождения газа в зоне катализатора.
Объемная скорость – это объем газовой смеси (м3), проходящей через единицу объема катализатора (м3) в час (м3/м3*ч)
Оптимальная интенсивность – определяется путем анализа взаимного влияния отдельных параметров процесса
Производительность катализатора – выражается в кг продукта (аммиака) на 1 м3 катализаторной массы за 1 час
С повышением объемной скорости объем аммиака с 1 м3 контактной массы возрастает, т.е. растет производительность кат.
Зависимость выхода аммиака от температуры
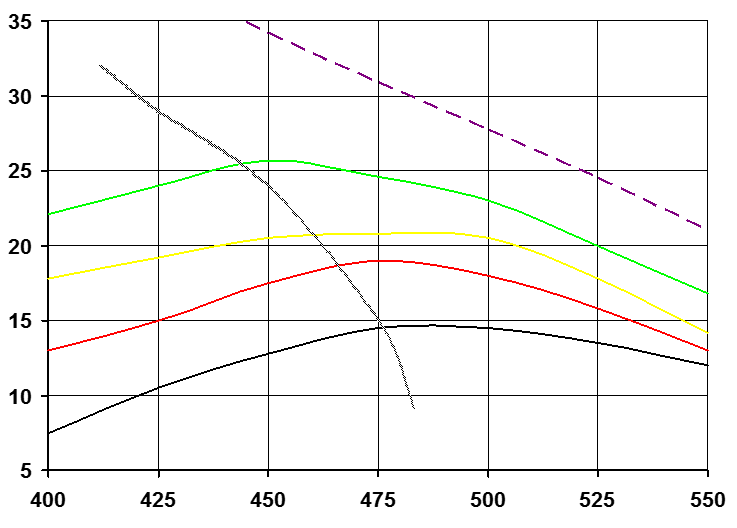
Содержание NH3 в газе, % об.
1
2
15000 ч-1
30000 ч-1
60000 ч-1
120000 ч-1
Т, °С
(Р=30 МПа): 1- кривая равновесия; 2- кривая оптимальных температур
Схема установки синтеза аммиака при среднем давлении
3
7
2
6
1
4
8
9
5
11
10
1 – колонна синтеза; 2 – паровой котел; 3 – водяной холодильник- конденсатор; 4 – сепаратор; 5 – турбоциркуляционный компрессор
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.