4.Выбирать путь расчеты, ведущий к минимальной ошибке
5.Учитывать возможную ошибку
6.Минимизировать время расчета
Методы расчета
1.)Полуэмпирические методы расчета, основанные на теоретических предпосылках.
Идеально-газовый закон(Мен-Клайп): pV=nRt
Ван-дер-Ваальса
раел.: (p+![]() )(V-b)=Rt
)(V-b)=Rt
2.)Методы расчета, основанные на конститутивных и аддитивных свойствах химических соединений.
Конститутивность – зависимость физико-химических свойств вещества от рода и числа атомов, групп атомов и способа связи в молекуле.
Аддитивность- одной группе атомов в различных веществах присущего одинаковые всойства.
3.)Методы расчета основанные на подобиях свойств различных веществ.
8. СТЕХИОМЕТРИЯ РЕАКЦИЙ
КЛАССИФИКАЦИЯ РЕАКЦИЙ
1) По механизму реакций: простые (одностадийные); сложные (многостадийные):
- параллельные; последовательные, последовательнопараллельные
2) По обратимости: - обратимые , необратимые
3) По молекулярности: мономолекулярные, бимолекулярные, тримолекулярные
4) По
порядку реакции – сумма показателей степеней концентрации в уравнении,
выражающем зависимость скорости хим реакции от концентрации реагирующих в- в. ![]() , n= a+r A+ R = B+D
, n= a+r A+ R = B+D
5) По тепловому эффекту: экзотермические (выделение теплоты), эндотермические (поглощение теплоты)
6) По использованию катализатора.(каталитические, некаталитические)
Стехиометрия –все количественные расчёты, связанные с реакцией.
![]()
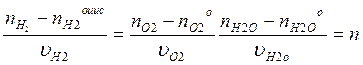
Полнота
реакции 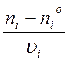
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Так как
стех.уравнение устанавливает соотношение между количеством превратившихся
веществ, оно является балансовым и ![]() предназначено
для расчета материальных балансов реакционных процессов. Если сложная реакция,
то число уравнений равно числу неизвестных.
предназначено
для расчета материальных балансов реакционных процессов. Если сложная реакция,
то число уравнений равно числу неизвестных.
Стехиометрически независимые реакции- реакции, уравнения кот-ых нельзя получить комбинацией уравнений других реакций (умножаем на постоянный множитель, сложением, вычитанием, умноженем). В сложной системе хим превращений число стехиометрически независимых реакций= рангу стехиометрич матрицы. В любой системе превращений наряду со стех независимыми реакциями определ-ся ключевые вещества, кол- во кот = числу стех независим реа- Ий и по кот- ым можно охарактеризовать материальный баланс всей системы уравнений. При выборе ключевых в- в учитывают: 1) в каждой независимой р- ии должно участвовать хотя бы одно ключевое вещ-во; 2) ключ в- ва должны участвовать в 1- ой или некотором минимуме независимых р- ий; 3) ключ вещ – ва должны легко определяться в хим системе (Δ n ij ) / ( υij ) = nj - для любой системы. Полнота j – той реакции есть изм- ие на стехиометрический коэф- т. Δ n i = Ε (Δ n ij ) . Δ n i - кол-во вещ- ва в любой системе. n i = n i 0 + Ε ( n j * υij )
9. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ
1) Массовая доля - отношение массы растворенного вещества ко всей массе смеси.
![]()
2) Мольная доля - отношение числа молей растворенного вещества в 1 моле раствора.
![]()
3) Объемная доля - отношение растворенного объема газа ко всему объему газовой смеси. Справедливо для газов.
![]()
4) Массовая концентрация - отношение массы растворенного вещества в 1 литре раствора.
![]()
5) Мольная концентрация (молярность) - отношение числа молей растворенного вещества в 1 литре раствора.
![]()
6) Моляльность - отношение числа молей растворенного вещества в 1кг растворителя.
![]()
7) Поверхностная концентрация - отношение числа частиц вещества, его количества или массы на поверхности данной системы к площади этой системы.
[ ХТП И ЕГО СОДЕРЖАНИЕ; КЛАССИФИКАЦИЯ ХТП; СХЕМА УСТАНОВКИ; ХАРАК-КИ УСТАНОВОК]
10. ХИМИКО-ТЕХНОЛОГИЧЕСКИЙПРОЦЕСС И ЕГО СОДЕРЖАНИЕ
Химико-технологический процесс - это процесс, в основе которого лежат химические реакции, сопровождаемые массо- и теплопереносом и используемый для получения готовой продукции из сырья.
 принципиальная
схема ХТП:
принципиальная
схема ХТП:
1 2 3
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.