13 Термодинамическое док-во II з-на Кановалова
Жидкости, имеющие максимум или минимум на кривых давление -состав соответствуют минимумы и максимумы на кривых Ткип – состав, причем в точкх минимума и максимума составы жидкой и паровой фазы равны.
Док-во: исходя из уравнения Гиббса - Дюгема, которое для бинарной смеси жидкостей на небольшом удалении от экстремума можно записать в таком виде.
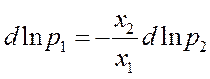
Подставляем в это выражение
Х1=1-Х2 :
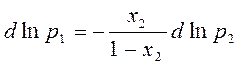
Выделяем из dp1 :
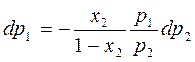
Давление p1 и р2 по з-ну Дальтона можно связать с составом паровой фазы:
р1=(1-у2)Р и р2=у2Р
Подставляем в предыдущее уравнение:
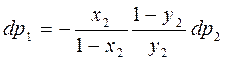
Полное давление по з-ну Дальтона равно сумме парциальных давлений:
Р=р1+ р2
Дифференцируем dP=dp1 +dp2
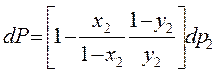
Поделим на dx2
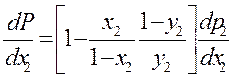
В точке экстремума ![]()
И кроме того первая производная
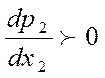
Откуда ![]()
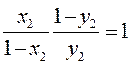
Это равенство выполняется при условии, что у2=х2 ,что и требовалось доказать.
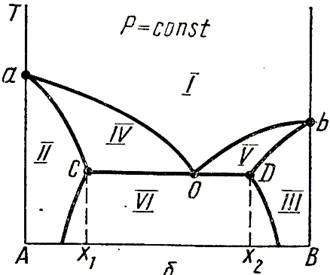
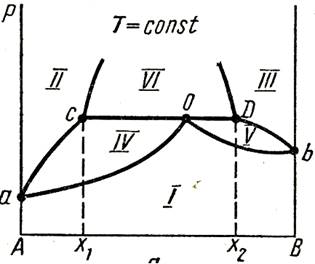
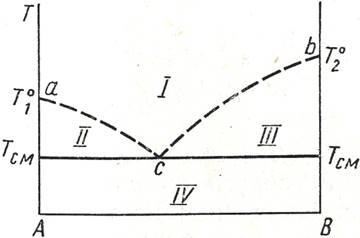
17.Диаграмма «давление – состав» и «температура – состав» ограниченно растворимых друг в друге.
Если система образована из 2х летучих ограниченно смешивающихся жидкостей, то при испарении такой двухфазной сис-мы пар будет содержать оба компонента и находиться в равновесии с каждой из жидких фаз.
Согласно правилу сосуществования фаз в гетерогенной сис-ме две фазы, находящиеся порознь в равновесии с третей фазой равновесны м/д собой.
Известно 2 типа систем, состоящих из ограниченно растворимых жидкостей. В системах первого типа общее давление пара над растворами любого состава больше давлений паров чистых жидкостей при той же температуре (Рº1<P> Pº2). Такая зависимость общего давления пара чистых компонентов и относительно малой взаимной растворимостью жидкостей (анилин-вода)
В системах второго типа общее давление пара над р-рами любого состава лежит между давлениями пара чистых жидкостей при той же температуре (Рº1<P< Pº2) Такая зависимость наблюдается в системах с резко отличающимися давлениями чистых жидкостей и относительно большой взаимной растворимостью жидкостей(никотин-вода)
Каждая диаграмма кривыми пара и жидкости делиться на ряд облостей:
I - область пара;
II – область первого жидкого раствора ;
III – область второго жидкого раствора ;
IV – область пара и первого жидкого раствора
V – область пара и второго жидкого раствора
VI – область двух жидких растворов.
Пунктиром показана кривая расслоения, которая полностью проявляется при более высоких давлениях.
С-му с ограниченной взаимной растворимостью компоненов 1-го типа перегонкой можно разделить на гетероазеатроп и один из чистых компонентов. Гетероазеатроп –гетерогенная жидкая сис-ма (т.О на рис.),состоящая из 2х ограниченно смешивающихся жидкостей, общий состав кот. Совпадает с составом пара, равновесного с 2-мя жидкими фазами (т.С и D). В с-мах с гетероазеатропом пар имеет состав, промежуточный м/д составами сосуществующих с ним жидких фаз. Гетероазеатропная смесь имеет наинизшую Ткип по сравнению с Ткип смесей любого др. состава, ее нельзя разделить методом перегонки на чистые компоненты.
1) Жидкости образующие гетероазеатроп
 2) Не
образующие гетероазеатроп
2) Не
образующие гетероазеатроп
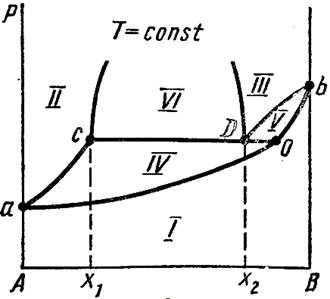
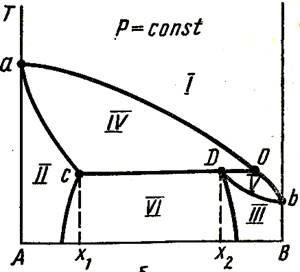
В системах, состоящих из таких жидкостей, испарение каждой жидкости происходит независимо от присутствия другой. Т-ра кип-я смеси таких жид-ей ниже т-ры кип-я чистых жид-ей, т.к. общее давление паров P над системой всегда выше давл-я каждого из комп-ов.
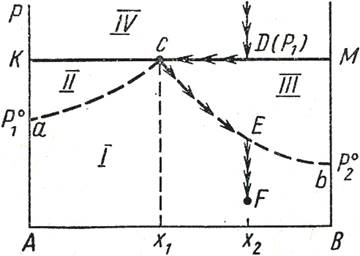
(1-перегретый пар; 2-жидкий компонент А и пар; 3-жидкий компонент В и пар; 4-две жидкие фазы.)
На графике 1 – например жидкая смесь обогащена комп-ом В (т. X2), то при давлении P1 (т.D) будут испаряться обе жид-ти и обр-ся пар состава X1 (т. C). Когда при испарении весь комп-т А перейдёт в пар, останется одна жидкая фаза – комп-т В. Дальнейшее исп-ие жид-го комп-та В приведёт изм-ю состава пара от X1 до X2 и к понижению давл-я (т. Е). Обр-ся пар ненасыщен комп-ом А. Если дальше понизить давл-е, до т.F, то это приведёт к тому, что пар станет ненасыщен и по отношению к комп-ту В.
16. Диаграммы растворимости ж-тей огран.раствор. друг в друге.
Если система образована из 2х летучих ограниченно смешивающихся жидкостей, то при испарении такой двухфазной сис-мы пар будет содержать оба компонента и находиться в равновесии с каждой из жидких фаз.
Согласно правилу сосуществования фаз в гетерогенной сис-ме две фазы, находящиеся порознь в равновесиис третей фазой.равновесны м/д собой.
При этом химические потенциалы равны между собой, т.е одинаковые.
Если рассматривать пар как ид. газ, то
μi (пар)= μºi(пар)+ RT ln Pi
Поскольку μºi(пар)= const при заданной температуре, то парциальное давление пара Pi одного и того же компонента над каждой из равновесных жидких фаз одинаково. Так как общее давление пара над раствором равно сумме парциальных давлений компонентов, то над обоими жидкими слоями при равновесии общее давление пара также одинаково
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.