



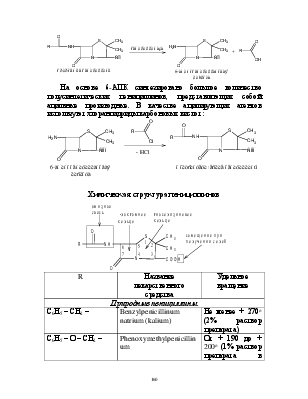










Лактамный цикл отличается высокой лабильностью к воздействию различных факторов.
Специфичность биологической активности пенициллинов обусловлена наличием в молекуле тиазолидинового и b-лактамного циклов. Расщепление одного из них приводит к полной потере активности. Важная роль в сохранении антибактериальной активности принадлежит также пространственной конфигурации молекул пенициллинов. Характер заместителей, присоединенных к гетероциклической системе в положениях 2 и 3 не оказывает заметного влияния на биологическую активность. Различную химическую структуру может иметь радикал, замещающий атом водорода в аминогруппе, которая присоединена к лактамному циклу в положении 6. Это позволило получить ряд высокоактивных полусинтетических аналогов, более устойчивых, чем природный пенциллин.
Бензилпенициллин и созданные на его основе многочисленные лекарственные формы отличаются наиболее высокой химиотерапевтической эффективностью и наименьшей токсичностью. Однако b-лактамный цикл бензилпенициллина легко разрушается под действием фермента пенициллиназы (b-лактамазы), продуцируемой многими микроорганизмами. Это обстоятельство послужило предпосылкой создания полусинтетических пенициллинов. В 1957 г. была выделена 6-аминопенициллановая кислота (6-АПК) – основа пенициллина. Получают 6-АПК из бензилпенициллина (или других пенициллинов), воздействуя ферментом пенициллиназой, продуцируемым бактериями. Процесс происходит по схеме:
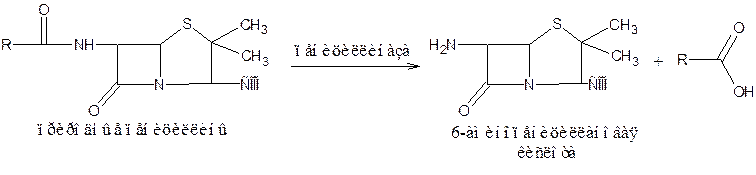
На основе 6-АПК синтезировано большое количество полусинтетических пенициллинов, представляющих собой ацильные производные. В качестве ацилирующих агентов используют хлорангидриды карбоновых кислот:
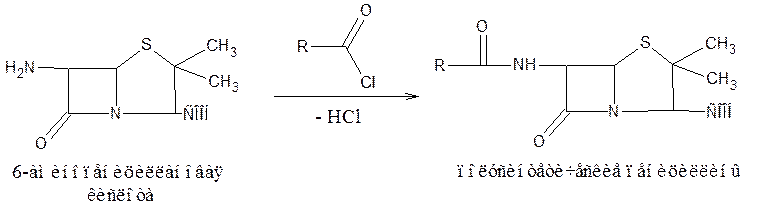
Химическая структура пенициллинов
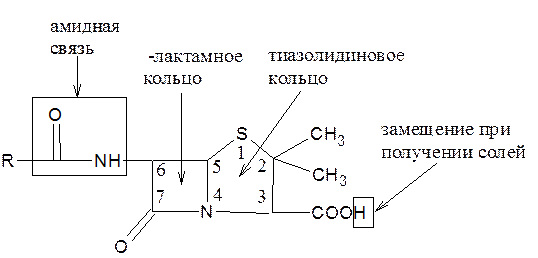
R |
Название лекарственного средства |
Удельное вращение |
|
Природные пенициллины |
|||
|
С6Н5 – СН2 – |
Benzylpenicillinum natrium (kalium) |
Не менее + 270о (2% раствор препарата) |
|
|
С6Н5 – О – СН2 – |
Phenoxymethylpenicillinum |
От + 190 до + 200о (1% раствор препарата в этаноле) |
|
Полусинтетические пенициллины |
|||
|
|
Ampicillinum |
От +280 до +305о (0,25% водный раствор препарата) |
|
|
|
Oxacillinum natrium |
Не менее +185о (1% водный раствор препарата) |
|
|
|
Carbenicillinum dinatrium |
От +182 до +196о (1% водный раствор препарата) |
|
|
|
Amoxicillinum |
||
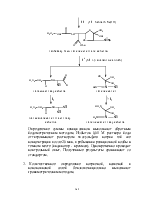
Пенициллины тормозят синтез полимеров клеточной стенки бактерий (биосинтез пептидогликана). Пенициллин действует на транс-пептидазу, осуществляющую образование поперечных сшивок, завершающих синтез клеточной стенки. В основе действия лежит сходство между пространственной ориентацией главных атомов и полярных групп пенициллинового ядра и одной из конформаций D-аланил-D-аланиновой концевой группы пентапептидной боковой цепи предшественника пептидогликана.
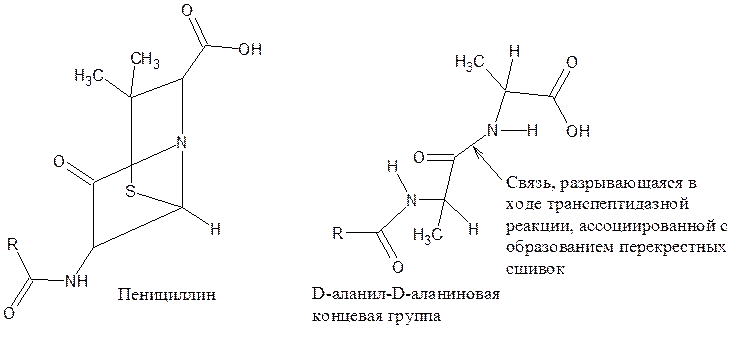
При сравнении структур обнаруживается соответствие в расположении пептидной связи, соединяющей аланиновые остатки, и связи в лактамной группе кольца пенициллина, ответственной за его ацилирующие свойства. Т.е. пенициллин связывается с ферментом транспептидазой вместо D-аланил-D-аланиновой концевой группы и тем самым ингибирует его деятельность.
Расстояние между атомами азота в пенициллине и дипептиде одинаково – 3,3 нм; расстояние между атомами углерода (- СООН) и атомом азота (кольца) также одинаково – 2,5 нм. Близки расстояния между углеродом (- СООН) и азотом амидной группы: у пенициллина – 5,4 нм; у D-аланил-D-аланиновой концевой группы – 5,7 нм.
По физическим свойствам препараты природных пенициллинов и их синтетические аналоги представляют собой белые или почти белые кристаллические порошки без запаха. Натриевая и калиевая соли бензилпенициллина слегка гигроскопичны.
Натриевая и калиевая соли бензилпенциллина, натриевая соль оксациллина, динатриевая соль карбенициллина легко растворимы в воде. Новокаиновая соль бензилпенициллина, феноксиметилпенициллин и ампициллин мало растворимы в воде. Натриевая и калиевая соли бензилпенициллина, феноксиметилпенициллин растворимы в этаноле; натриевая соль оксациллина в этаноле трудно растворима, а динатриевая соль карбенициллина медленно растворима.
Подлинность препаратов пенициллинов подтверждается с помощью УФ- и ИК-спектрометрии и удельному вращению водных или спиртовых растворов.
1. Цветная реакция, основанная на разрыве b-лактамного кольца и образовании медной соли гидроксамовой кислоты (осадок зеленого цвета) (гидроксаматы железа III красного цвета).
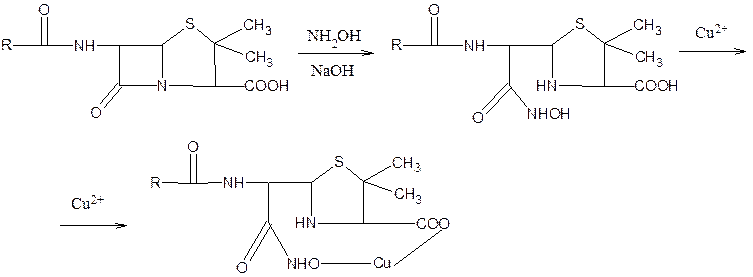
2. Обнаружение органически связанной серы после превращения ее в сульфид-ион сплавлением с едкими щелочами.
3. Обнаружение ионов натрия или калия после предварительной
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.