

ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
Государственное образовательное учреждение высшего профессионального образования
Национальный исследовательский университет ресурсоэффективных технологий «ТПУ» (НИУ РЭТ ТПУ).
Химико-технологический факультет. Кафедра ТООС и ВМС
Направление-24000 «Химия и биотехнология».
Лекционный курс-«Химия и технология органических веществ»
ТЕМА
Термодинамическая возможность протекания химической реакции
Для закрытых систем, находящихся в изобарно-изотермических либо изохорно-изотермических условиях свободная энергия принимает вид изобарно-изотермического либо изохорно-изотермического потенциалов (т.н. свободная энергия Гиббса (ΔG) и Гельмгольца (ΔF) соответственно). Данные функции называют иногда просто термодинамическими потенциалами, что не вполне строго, поскольку термодинамическими потенциалами являются также внутренняя энергия (изохорно-изэнтропный) и энтальпия (изобарно-изэнтропный потенциал).
Протекание самопроизвольного процесса в закрытой системе сопровождается уменьшением свободной энергии системы (dG < 0, dF < 0).
В практике возможен расчет по следующим вариантам:
1. Используя экспериментальные значения ΔGилиΔF при необходимых условиях.
2.
Используя
экспериментальные значения ΔНиΔS при необходимых условиях и далее расчет по формуле ![]()
3. Используя эмпирические методы расчета значений ΔН,ΔS, ΔG, ΔF при необходимых условиях.
4. Используя теоретические методы расчета значений ΔН,ΔS, ΔG, ΔF при необходимых условиях..
Пример 1. Получится ли 1,2-дибромэтан, если бромировать этилен при 298° К встандартном состоянии
С2Н4 (г) + Вг2 (ж) = С2Н4Вг2 (ж)
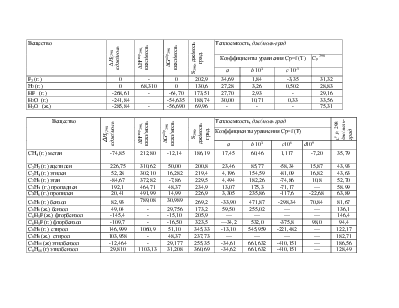
Из приложения 1 выписываем значения DGо298
С2Н4 (г) Вг2 (ж) С2Н4Вг2 (ж)
DGо298, кал/моль 16,282 0 -4,940
Тогда
DGо298= -4,940 -16,282= -21,122 ккал.
Следовательно, в указанных условиях может образоваться 1,2-дибромэтан.
Пример 2. Определить, возможна ли реакция крекинга гексадекана при 298° К
С16Н34(ж) = С5Н12 (г) + 2С4Н8 (г) + С3Н6 (г)
н-пентан изобутан пропилен
Решение. В приложении 1 находим необходимые термодинамические данные:
|
Функция |
С16Н34 |
С5Н12 |
С4Н8 |
С3Н6 |
|
DНо0бр298,ккал/моль |
-108,58 |
-35,0 |
-4,04 |
4,88 |
|
S298, кал/мольград |
148,1 |
83,4 |
70,17 |
63,8 |
DНо0бр298= -35,0 - 4,04*2 + 4,88 + 108,58 = 70,38 ккал/моль
S298 = 83,4 + 70,17*2 + 63,8 - 148,1 = 139,44 кал/мольград,
Находим изобарно-изотермический
потенциал (Гиббса) по формуле ![]()
DGо298= 70380 – 298*139,44 = 28 827 кал.
Разложение гексадекана до указанных продуктов при 298° К невозможно.
Пример 3. Возможна ли реакция дегидроциклизации н-октана в п-ксилол при 800° К
С8Н18 (г) « п-ксилол (г) + 4Н2
Решение. Из стандартных таблиц (приложение 1)
|
Функция |
С8Н18 (г) |
С6Н4(СН3)2 |
Н2 |
D реакции |
|
DНо0бр298,ккал/моль |
-49,82 |
4,290 |
0 |
54,11 |
|
S298, кал/мольград |
111,55 |
84,23 |
31,211 |
97,524 |
|
А, кал/град моль |
1,651 |
-6,196 |
6,95 |
19,953 |
|
b103, кал/град моль |
177,317 |
145,716 |
-0,2 |
-32,4 |
|
c106, кал/град моль |
-94,95 |
-83,786 |
0,48 |
13,084 |
При 800°К из приложения 16: М0 = 0,3597; М1 10-3 = 0,1574; M2 10-6 = 0,0733.
По уравнению Шварцмана-Темкина:
![]()
DG0800 = 54110 - 800*97,524 – 800 (0,3597*19,953 - 0,1574*32,4 + 0,0733-13,084)
= -21 880 кал/моль
Реакция при 800° К возможна в прямом направлении.
Значения коэффициентов для вычисления термодинамических функций по уравнению Шварцмана-Темкина (Приложение 16)
Т, °К |
М0 |
М1 10-3 |
M2 10-6 |
М-2105 |
|
300 |
0,0000 |
0,0000 |
0,0000 |
0,0000 |
|
400 |
0,0392 |
0,0130 |
0,0043 |
0,0364 |
|
500 |
0,1133 |
0,0407 |
0,0149 |
0,0916 |
|
600 |
0,1962 |
0,0759 |
0,0303 |
0,1423 |
|
700 |
0,2794 |
0,1153 |
0,0498 |
0,1853 |
|
800 |
0,3597 |
0,1574 |
0,0733 |
0,2213 |
|
900 |
0,4361 |
0,2012 |
0,1004 |
0,2521 |
|
1000 |
0,5088 |
0,2463 |
0,1134 |
0,2783 |
|
1100 |
0,5765 |
0,2922 |
0,1652 |
0,2988 |
|
1200 |
0,6410 |
0,3389 |
0,2029 |
0,3176 |
|
1300 |
0,7019 |
0,3860 |
0,2440 |
0,3340- |
|
1400 |
0,7595 |
0,4336 |
0,2886 |
0,34835 |
|
1500 |
0,8141. |
0,4814 |
0,3362 |
0,3610 |
|
1600 |
0,8665 |
0,5296 |
0,3877 |
0,3723 |
|
1700 |
0,9162 |
0,5780 |
0,4424 |
0,3824 |
|
1800 |
0,9635 |
0,6265 |
0,5005 |
0,3915 |
|
1900 |
1,009 |
0,6752 |
0,5619 |
0,3998 |
|
2000 |
1,0525 |
0,7240 |
0,6265 |
0,4072 |
Задание.
1. Определить по энергии Гиббса возможность протекания реакций при 2980К: ацетилен® этилен®этан
2. Определить по DНо0бр298 и S298 возможность протекания реакций: бензол ® фторбензол
3. Определить температуру, при которой возможно протекание следующей
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.