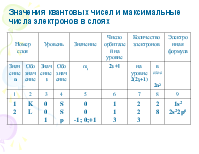
определяет пространственное расположение атомной орбитали и принимает целые значения
от –l до + l через нуль,
то есть 2l + 1 значений.


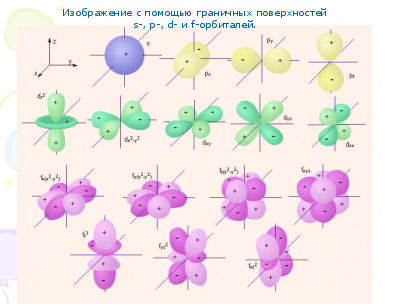
Изображение с помощью граничных поверхностей
s-, p-, d- и f-орбиталей.
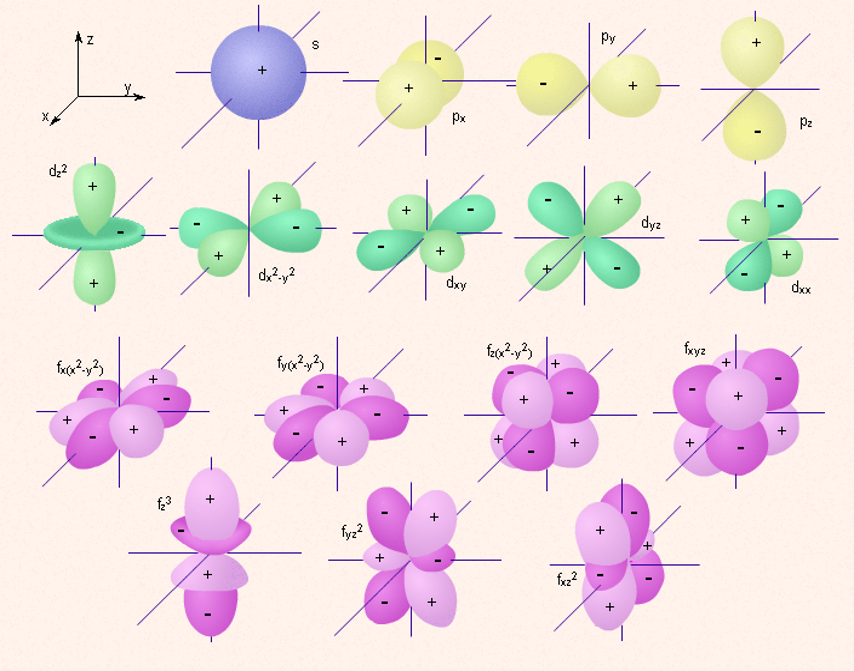
-
s-Орбитали сферически симметричны для любого n и отличаются друг от друга только размером сферы. Их максимально симметричная форма обусловлена тем, что при l = 0 и ml = 0.
-
p-Орбитали существуют при n ≥ 2 и l=1, поэтому возможны три варианта ориентации в пространстве: ml= –1, 0,+1. Все p-орбитали обладают узловой плоскостью, делящей орбиталь на две области, поэтому граничные поверхности имеют форму гантелей, ориентированных в пространстве под углом 90° друг относительно друга. Осями симметрии для них являются координатные оси, которые обозначаются px, py, pz.
-
d-Орбитали определяются квантовым числом l = 2 (n ≥ 3), при котором ml = –2, –1, 0, +1, +2, то есть характеризуются пятью вариантами ориентации в пространстве. d-Орбитали, ориентированные лопастями по осям координат, обозначаются dz² и dx²–y², а ориентированные лопастями по биссектрисам координатных углов – dxy, dyz, dxz. Называются условно бабочкой.
-
Семь f-орбиталей, соответствующих l = 3 (n ≥ 4), изображаются в виде граничных поверхностей, имеют сложную конфигурацию.
ms -спиновое квантовое число
-
Экспериментально установленно, что электрон имеет еще одно свойство – спин. Спиновое квантовое число ms имеет только два значения ms = ±1/2, определяет собственный момент количества движения электрона.
-
Упрощенно спин можно представить как вращение электрона вокруг собственной оси.
-
Электроны с разными ms обозначаются стрелками, направленными вверх и вниз .
Заполнение атомных орбиталей
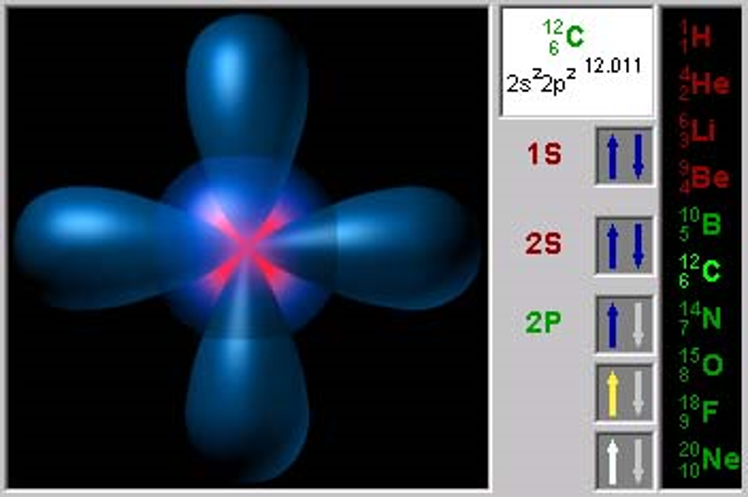
Принцип наименьшей энергии
-
При застройке атома каждый электрон размещается на той обитали, которой соответствует минимальное значение энергии, т.е. ближе расположенной к ядру атома.
-
Принцип наименьшей энергии требует, чтобы электроны заселяли АО в порядке увеличения энергии электронов на этих орбиталях. Это отражает общее правило – максимуму устойчивости системы соответствует минимум ее энергии.
Принцип Паули
-
В атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел, или данными значениями квантовых чисел характеризуется только один электрон.
-
Отсюда на S-уровне может быть не более двух, p- шести, d- десяти, f- четырнадцати электронов.
-
На каждом энергетическом слое должно быть 2n2 электронов.
Последовательность застройки электронной оболочки многоэлектронного атома подчиняется следующим эмпирическим правилам:
-
при застройке на последнем слое не должно быть больше восьми электронов;
-
застройка любого слоя начинается с S-уровне;
-
р-уровни для элементов малых периодов периодической системы застраиваются после S-уровней, а для элементов больших периодов- после d-уровней предыдущего слоя;
-
d-уровни предыдущего слоя застраиваются после S- орбиталей последнего энергетического слоя;
-
f-уровни IV и V слоев застраиваются соответственно после S-уровня VI и VII слоев.
Правило Хунда:
-
суммарное спиновое число электронов данного уровня должно быть максимальным.
-
Иными словами, орбитали данного уровня заполняются сначала по одному, затем по второму электрону. Поскольку основной запас энергии электрона определяют квантовые числа n и l, то последовательность застройки атомных орбиталей определяется суммой n+l.
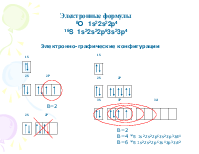
Электронные формулы
8О 1s22s22p4
16S 1s22s22p63s23p4
Электронно-графические конфигурации
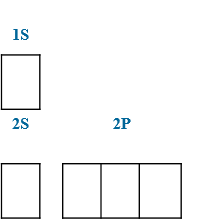
В=2

В=2
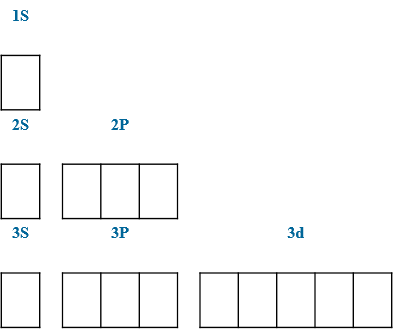
В=4 *S 1s22s22p63s23p33d1
В=6 *S 1s22s22p63s13p33d2
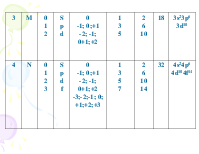
правилa Клечковского
-
1. Минимумом энергии обладают обитали с наименьшей суммой главного и побочного квантовых чисел n+l.
-
Сравним 4S-орбиталь и 3d-орбиталь
-
4S : n+l = 4+0 = 4,
-
3d : n+l = 3+2 = 5.
-
n 1 2 3 4
-
l 0 1 2 3
-
s p d f
-
В соответствии правилом электроны в первую очередь заполняют 4S, а потом 3d-орбиталь
правилa Клечковского
-
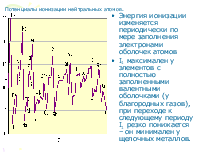
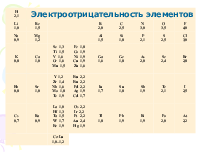
2. При одинаковых значениях суммы n+l меньшей энергией обладает


















































![]()




