Строение атома и химическая связь
Квантовая механика
Корпускулярно-волновой дуализм
В 1924 г. французский физик Луи де Бройль высказал предположение: «Любая движущаяся частица одновременно обладает и механическими и волновыми свойствами». Предположение де Бройля подтвердилось экспериментально на явлении дифракции электронов и нашло применение в электронных микроскопах.
Корпускулярно-волновой дуализм
Эта зависимость выражается уравнением: , где – длина волны; h – постоянная Планка, 6,6·10 -34 Дж·с; m – масса частицы (электрона); ν – скорость частицы.
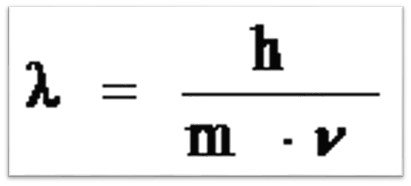
Принцип неопределенности
В 1925 г. немецкий физик В. Гейзенберг высказал положение: «Для микрочастицы атомного масштаба невозможно одновременно и точно указать координату и скорость ее движения».
Принцип неопределенности
Математическое выражение этого положения: , где ∆q – неопределенность координат, или положения в пространстве; ∆p – неопределенность импульса, p = m·v, где m – масса, V – скорость; h – постоянная Планка, ћ – приведенная постоянная Планка.
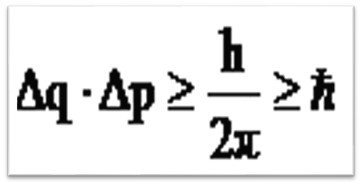
Принцип неопределенности
Волновое уравнение
В 1926 г. австрийский ученый Э. Шредингер предложил уравнение с помощью которого вычисляют вероятность нахождения электрона в атоме: ,
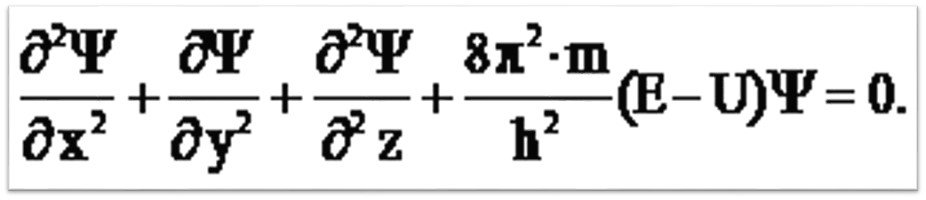
Волновое уравнение где сумма вторых производных волновой функции (пси) ; m – масса электрона; h – постоянная Планка; E – полная энергия электрона; U – потенциальная энергия электрона – функция координат x, y, z, называемая волновой функцией (орбиталью) и является основной характеристикой электрона в атоме.
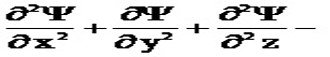
Квантово-механическая модель атома
Квантово-механическая модель атома
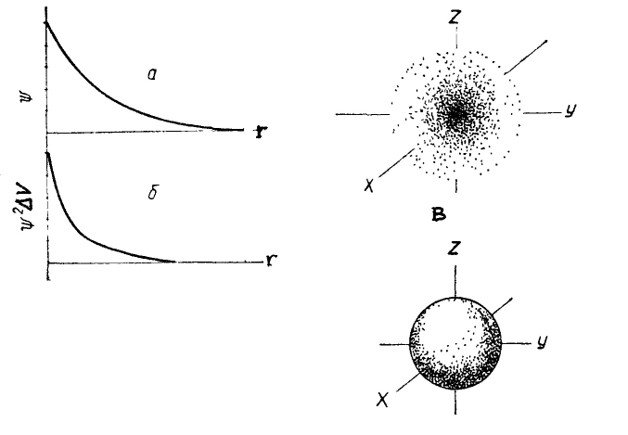
Способы изображения распределения электронной плотности в атоме водорода: графики зависимости ψ – r(a), ψ2dv – r(б), электронное облако (в), орбиталь (2)
Квантово-механическая модель атома
Орбиталь – фигура, образованная движением электрона и составляющая примерно 95% электронного облака.Возможны различные формы орбиталей: s-, p-, d- и f-
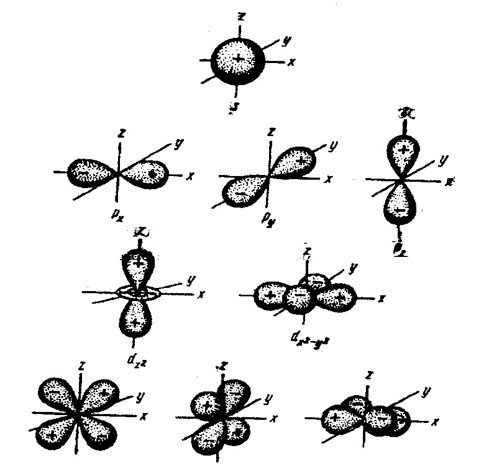
Квантовые числа
Энергетическое состояние электрона в атоме характеризуется четырьмя квантовыми числами; n – главное, ℓ - орбитальное, m – магнитное, s – спиновое. Все эти числа характеризуют определенную энергию электрона.
n - главное квантовое число
l - побочное (орбитальное) квантовое число
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.