Министерство высшего и среднего специального образования РСФСР
Сибирский ордена Трудового Красного Знамени металлургический институт имени
Серго Орджоникидзе
ИЗМЕРЕНИЕ ОТНОШЕНИЯ ТЕПЛОЕКМОСТИ ВОЗДУХА
ПРИ ПОСТОЯННОМ ДАВЛЕНИИ К ЕГО ТЕПЛОЕМКОСТИ
ПРИ ПОСТОЯННОМ ОБЪЕМЕ
Лабораторный практикум по курсу "Общая физика"
Издание СМИ Новокузнецк 1969
УДК 533.7:536.63
Рассмотрен метод Клемана-Дезорма. для определения показателя адиабаты газа.
Работа предназначена для студентов всех специальностей дневного, вечернего и заочного обучения.
Рецензент - кафедра высшейматематики Сибирского металлургического института(зав. кафедрой П,).
Печатается по решению редакционно-издательского coветa института, протокол №5 от 7 февраля 1989 г.
Задачей эксперимента является измерение отношения теплоемкости воздуха при постоянном давлении к его теплоемкости при постоянном объеме.
Для измерения предлагается метод адиабатического расширения газа с последующей изохорической выдержкой.
Теплоемкостью тела называется физическая величине, числено равная количеству теплоты, которое необходимо сообщить телу, чтобы повысить его температуру на один градус.
Теплоемкость единицы массы называется удельной теплоемкостью, в теплоемкость одного моля вещества - молярной теплоемкое ты». Таким образом, c = dQ , (1)
![]() dT
dT
c = mdQ⋅dT , (2)
где с и Сµ - удельная и молярная теплоемкости соответственно; dQ - количество теплоты; dТ - изменение температуры; m - масса вещества; µ - молярная масса вещества.
Молярная к удельная теплоемкости связаны соотношением Сµ =µ⋅с.
Величина теплоемкости вещества зависит от условий нагревания и температуры.
Рассмотрим теплоемкости идеального газа при его изобарическом (P=const) и изохорическом (V=const) нагревании.
Из первого начала термодинамики следует, что подведенная к газу теплота dQ расходуется на увеличение его внутренней энергии dU и на совершение работы против внешних сил dA:
dQ = dU + dA. (3)
Изменение внутренней энергии идеального газа равно
dU ![]() RdT,
(4) где i - число степеней свободы. (Число независимых
координат, однозначно определяющих положение частицы в пространстве. Для одноатомных
молекул i = 3; двухатомных - i = 5; многотомных - i = 6). Для изобарического
процесса dA
RdT,
(4) где i - число степеней свободы. (Число независимых
координат, однозначно определяющих положение частицы в пространстве. Для одноатомных
молекул i = 3; двухатомных - i = 5; многотомных - i = 6). Для изобарического
процесса dA ![]() dT,
(5) тогда из уравнений (3)-(5) имеем:
dT,
(5) тогда из уравнений (3)-(5) имеем:
dQ
![]() .
.
Для изохорического процесса dA=0. dQ ![]() .
(6)
.
(6)
Из (2), (5) и (6) имеем:
Cp = i +22 , (7)
CV = 2i , (8) отношение теплоемкостей
![]() CCVp = i + 2 .
(9) γ
= i
CCVp = i + 2 .
(9) γ
= i
Таким образом, теплоемкость идеального газа не зависит от температуры и является функцией процесса.
Адиабатическим называется процесс, протекающий
без теплообмена с окружающей средой (dQ=0). Описывается он уравнениями Пуассона:
p ⋅
Vγ
=
const, T ![]() const, T ⋅
Vγ−1 =
const.
(10)
const, T ⋅
Vγ−1 =
const.
(10)
Поэтому γ называют еще коэффициентом Пуассона или показателем адиабаты.
Идеальная теплоизоляция системы невозможна. В этом смысле адиабатический процесс является реальным. Быстрые реальные процессы можно считать адиабатическими (теплообмен не успевает происходить в заметной степени).
Показатель адиабаты, рассчитанный по формуле (9) через степени свободы, назовем теоретическим, а измеренный с использованием уравнений Пуассона (10) - экспериментальным.
Закачаем газ в некоторый сосуд и изохорически выдержим. Процессы предста-
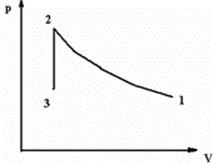
вим графиком рис.1.
Рис.1. Закачивание воздуха в сосуд и его изохорическая выдержка
Процесс закачивания (1→2) может быть близким к адиабатическому (быстрому) или изотермическому (медленному).
Откроем сосуд, дадим части газа возможность покидать сосуд достаточно быст-
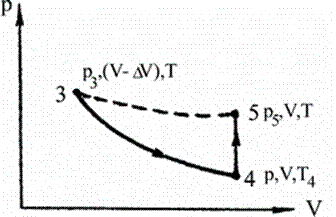
ро (адиабатически) до выравнивания давления внутри и вне сосуда
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.