Цель работы – определить степень и константу диссоциации слабой кислоты путём измерения электропроводности раствора.
Сущность работы – при титровании сильной кислоты щелочью электропроводность раствора до точки эквивалентности линейно понижается, т.к. нейтрализуются высокоподвижные ионы водорода. Нейтрализация слабой кислоты сопровождается повышением проводимости раствора до точки эквивалентности, что объясняется образованием хорошо диссоциирующей соли. Избыток щелочи при титровании вызывает резкое повышение электропроводности раствора. По кондуктометрическим кривым находят число миллилитров раствора щелочи, вступившего в реакцию с кислотами, и рассчитывают их содержание в титруемом растворе, пользуясь известными формулами.
На оси ординат откладывают электропроводность, а на оси абсцисс – объем титранта. По точке эквивалентности, найденной графически, вычисляют концентрацию электролита:
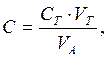 (1)
(1)
где СТ – концентрация титранта, г-экв/л; VT – объём титранта, установленный по точке эквивалентности, мл; VA – объём пробы анализируемого раствора, мл.
1). Построение кривой кондуктометрического титрования:
Таблица полученных измерений:
|
VT |
|
|
0 |
221,3 |
|
1 |
213,9 |
|
2 |
211,8 |
|
3 |
209,8 |
|
4 |
209,4 |
|
5 |
209,2 |
|
6 |
206,3 |
|
7 |
205,8 |
|
8 |
197,2 |
|
9 |
189,4 |
|
10 |
188 |
|
11 |
207 |
|
12 |
229,9 |
|
13 |
247,8 |
Пользуясь результатами измерения, построим график зависимости электропроводности от объема титранта:
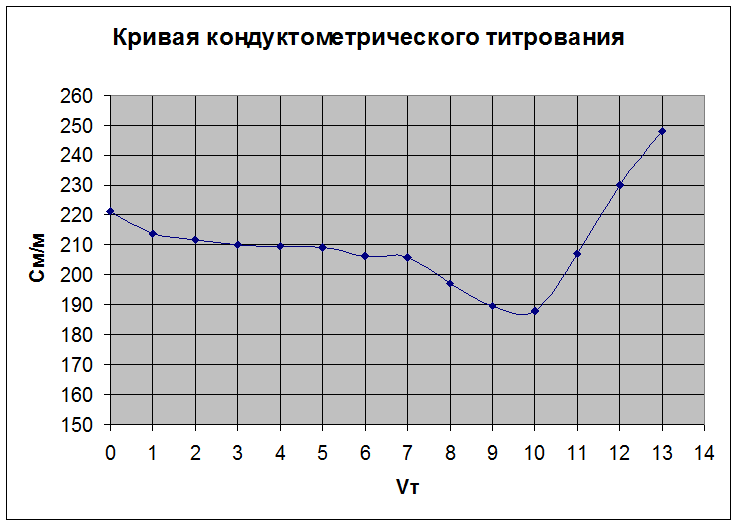
На графике получили точку эквивалентности с координатами: Это означает, что VT =18. По формуле (1) находим концентрацию электролита:
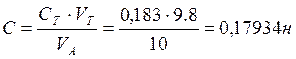 .
.
Из графика видно, что титрование проводилось слабой кислоты щелочью.
2).
Таблица полученных результатов:
|
Электролит |
Концетрация р-ра Экв/л |
|
|
4 |
0,0016 |
64,6 |
|
3 |
0,008 |
130,8 |
|
2 |
0,04 |
297,4 |
|
1 |
0,2 |
662 |
1)
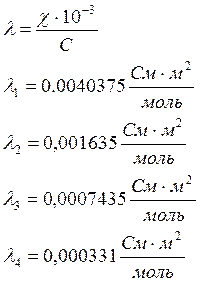
2)
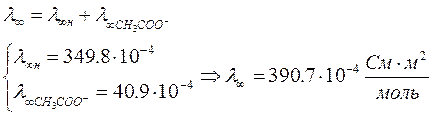
3)
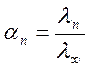
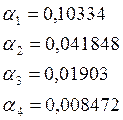
4)
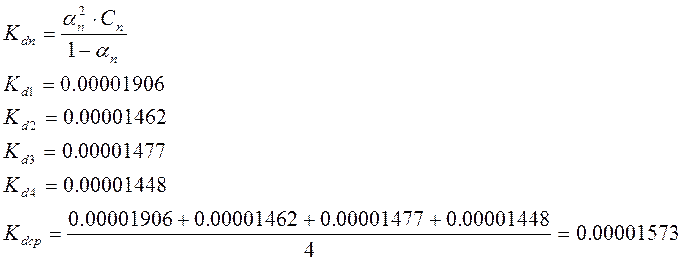
5)
![]()
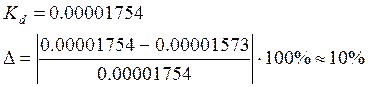
6)
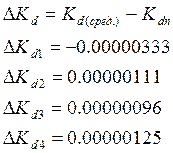
7)
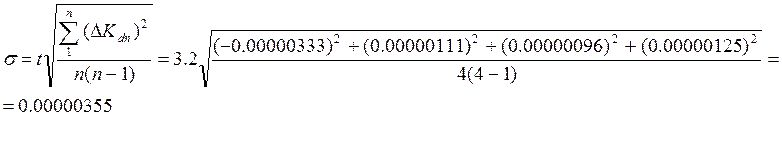
8)
![]()
График зависимости удельной электропроводности от концентрации ![]()
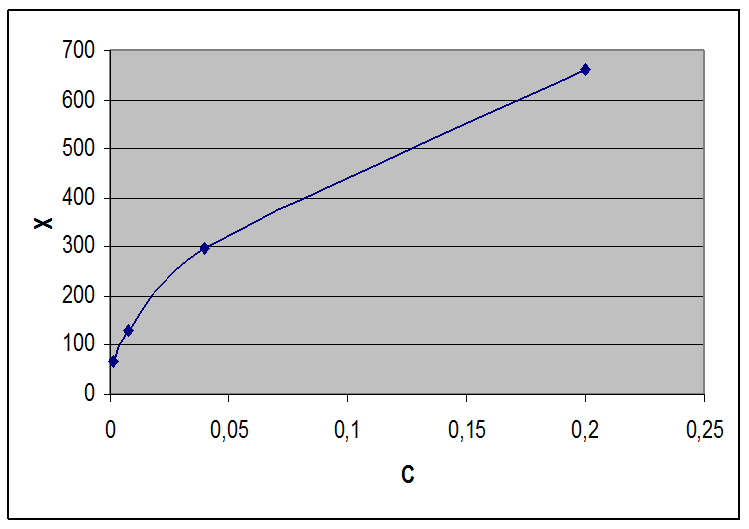
График зависимости эквивалентной проводимости от квадратного корня концентрации

Федеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального образования
Санкт-Петербургский государственный горный институт им. Г.В. Плеханова
(технический университет)

Лабораторная работа
(наименование учебной дисциплины согласно учебному плану)
Выполнил: студент гр. ОП-04 ______________ / А.О./
(подпись) (Ф.И.О.)
Дата: __________________
(должность) (подпись) (Ф.И.О.)
Санкт-Петербург
2006
Цель работы: Определение константы нестойкости энергии Гиббса образования тиоционата комплекса железа (III).
Приборы и реактивы:
Основные понятия и формулы:
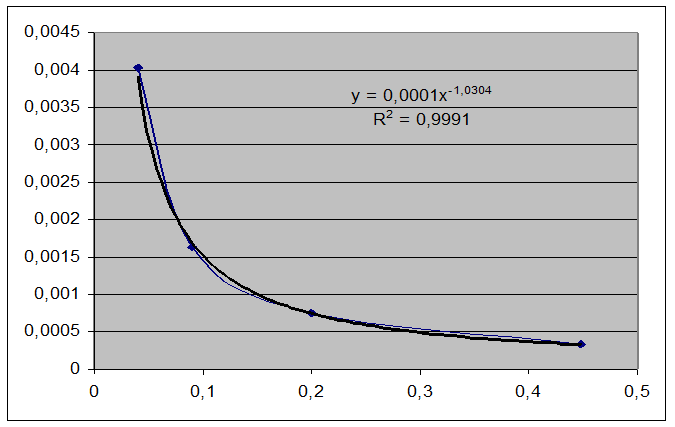
Константой нестойкости называют константу равновесия диссоциации комплекса на составляющие его ионы или молекулы
![]()
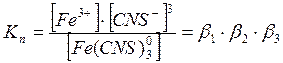
Свободная энергия диссоциации комплекса на ионы равна:
![]()
По закону Гесса:
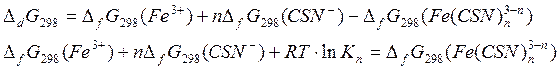
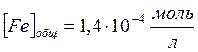
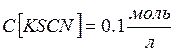
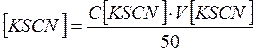
|
n=1 |
|||||
|
моль/л |
мл. |
D |
моль/л |
моль/л |
моль/л |
|
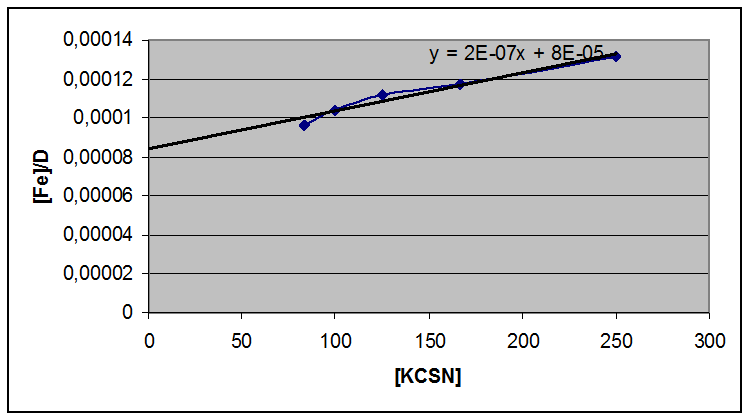
1.4*10-4 |
2 3 4 5 6 |
1.066 1.193 1.248 1.348 1.452 |
0.000131 0.000117 0.000112 0.000103 0.000096 |
0.004 0.006 0.008 0.010 0.012 |
250 166 125 100 83 |
![]()
![]()
![]()
![]()
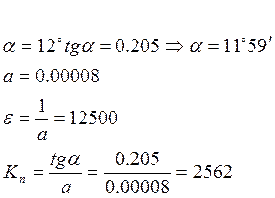
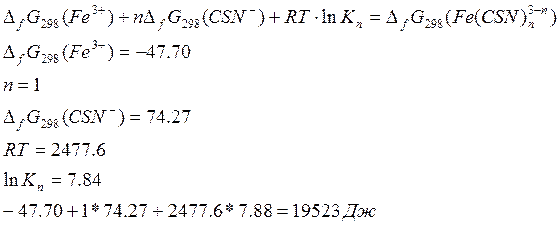
|
n=2 |
|||||
|
моль/л |
мл. |
D |
моль/л |
моль/л |
моль/л |
|
1.4*10-4 |
2 3 4 5 6 |
1.066 1.193 1.248 1.348 1.452 |
0.000131 0.000117 0.000112 0.000103 0.000096 |
0.004 0.006 0.008 0.010 0.012 |
62500 27777.78 15625 10000 6944.44 |
![]()
![]()
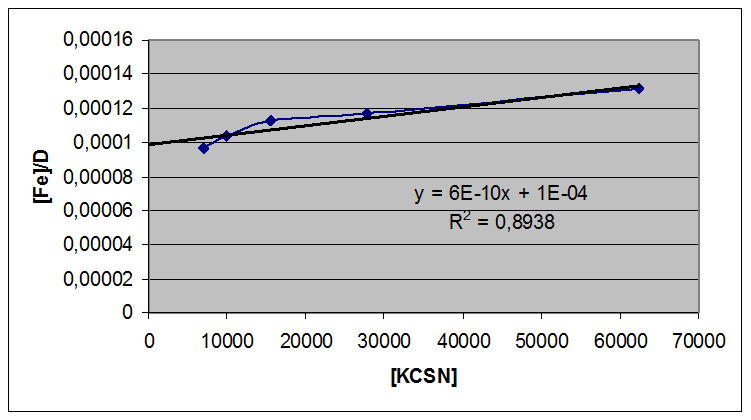
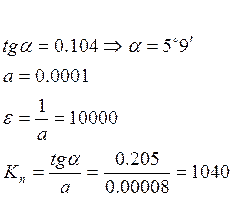
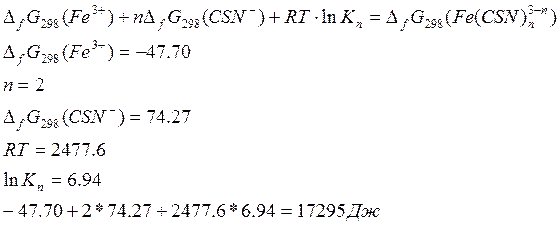
|
n=3 |
|||||
|
моль/л |
мл. |
D |
моль/л |
моль/л |
моль/л |
|
1.4*10-4 |
2 3 4 5 6 |
1.066 1.193 1.248 1.348 1.452 |
0.000131 0.000117 0.000112 0.000103 0.000096 |
0.004 0.006 0.008 0.010 0.012 |
15625000 4629630 1953125 1000000 578703.7 |
![]()
![]()
![]()
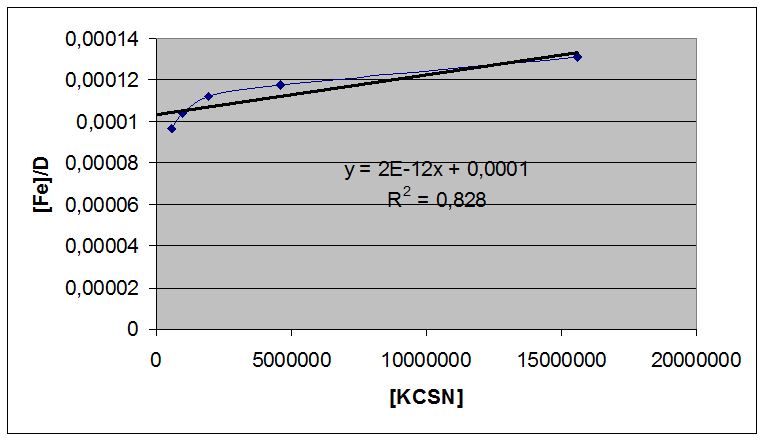
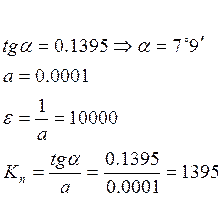
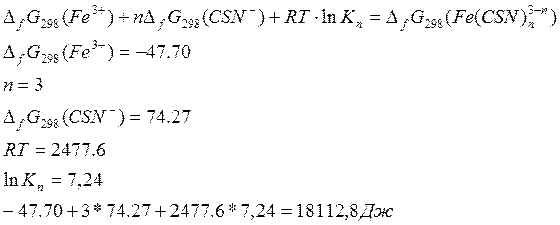

Федеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального образования
Санкт-Петербургский государственный горный институт им. Г.В. Плеханова
(технический университет)

Лабораторная работа
Тема: Экстракционное разделение и извлечение катионов цветных металлов
Выполнил: студент гр. ОП-04 ______________ / А.О./
(подпись) (Ф.И.О.)
Дата: __________________
(должность) (подпись) (Ф.И.О.)
Санкт-Петербург
2006
Цель работы:
Определить зависимость коэффициента распределения между водным раствором и карбоновой кислоты для иона никеля в зависимости от рН водной среды.
Сущность работы:
Экстракция ионов металла карбоновыми кислотами сопровождается реакцией:
![]()
В силу того, что в результате реакции образуются Н+, прохождение реакции будет сильно зависеть от рН раствора:
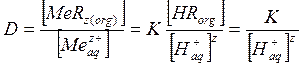 ,
,
Логарифмирование этого выражения приводит к выражению:
lgD=lgK+zpH, т.е. линейной зависимости логарифма коэффициента распределения от рН водного раствора. Наличие прямолинейной зависимости и совпадение угла наклона прямой с зарядом металла говорит о правильности выбранной модели взаимодействия между экстрагентом и экстрагируемым веществом.
Порядок выполнения работы:
Результаты измерений:
|
№ опыта |
Количество щелочи, мл |
VтрБ, мл |
рН |
|
|
D |
lgD |
|
1 |
1 |
8.5 |
5.3 |
0,0425 |
0,0053 |
0.12 |
1.20 |
|
2 |
1,5 |
8.3 |
5.4 |
0,0415 |
0,0058 |
0.14 |
1.21 |
|
3 |
2 |
8.2 |
5.6 |
0,0410 |
0,0056 |
0.13 |
1.22 |
|
4 |
2,5 |
8 |
5.8 |
0,0400 |
0,0062 |
0.15 |
1.23 |
|
5 |
Исходный раствор |
9.5 |
5 |
0,0475 |
- |
- |
- |
Для 1-го опыта:
Концентрация ![]() в
водной фазе:
в
водной фазе:
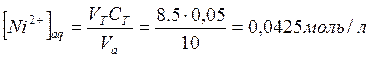
Концентрация ![]() в
органической фазе:
в
органической фазе:
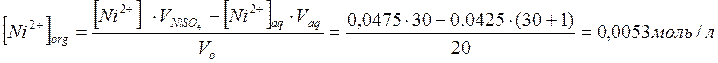
Распределение никеля между двумя фазами:
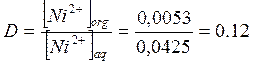
Для 2-го опыта:
Концентрация ![]() в
водной фазе:
в
водной фазе:
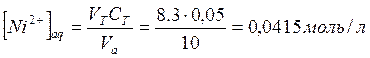
Концентрация ![]() в
органической фазе:
в
органической фазе:
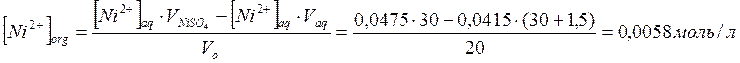
Распределение никеля между двумя фазами:
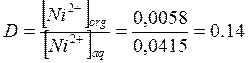
3-го опыта:
Концентрация ![]() в
водной фазе:
в
водной фазе:
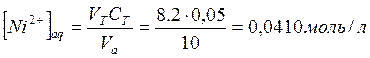
Концентрация ![]() в
органической фазе:
в
органической фазе:
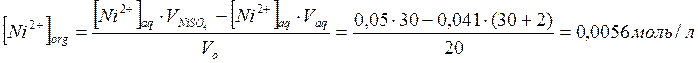
Распределение никеля между двумя фазами:
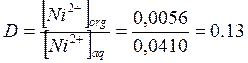
4-го опытов:
Концентрация ![]() в
водной фазе:
в
водной фазе:
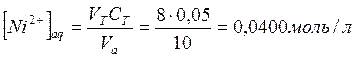
Концентрация ![]() в
органической фазе:
в
органической фазе:
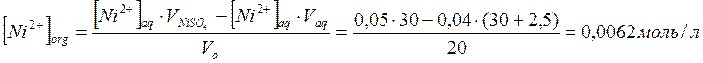
Распределение никеля между двумя фазами:
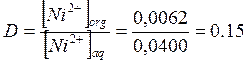
Для исходного раствора:
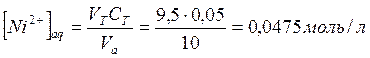
Построим график зависимости логарифма распределение металла между
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.