
Федеральное агентство по образованию Российской Федерации
Государственное образовательное учреждение высшего профессионального образования
Санкт-Петербургский Государственный Горный институт им. Г.В.Плеханова
 |
Отчёт по лабораторной работе № 1.
(наименование учебной дисциплины согласно учебному плану)
Выполнил: студент гр. ОП-03 ______________ / /
(подпись) (Ф.И.О.)
ОЦЕНКА: _____________
Дата: __________________
(должность) (подпись) (Ф.И.О.)
Санкт-Петербург
2006 г.
Цель работы:
ü применяя статический метод, исследовать влияние концентрации растворов на удельную адсорбцию слабой кислоты активированным углём;
ü используя полученные экспериментальные данные, построить изотерму адсорбции, проверить применимость к ней уравнений изотерм адсорбций Фрейндлиха и Ленгмюра, а также найти постоянную этих уравнений;
ü оценить удельную поверхность активированного угля.
Полученные экспериментальные данные и их обработка.
1. Определение точной концентрации С0 исходного раствора уксусной кислоты титрованием её аликвоты в 5 мл 0,1н. раствора гидроксида натрия в присутствии 3 – 5 капель спиртового раствора фенолфтолеина.
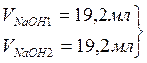
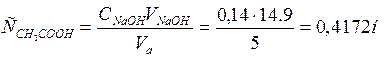
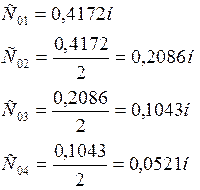
2. Определение равновесной концентрации уксусной кислоты.
|
Номер раствора (колбы) |
Объём аликвоты Vа, мл |
Эквивалентный объём щёлочи VNaOH, мл |
Равновесная концентрация кислоты С, моль/л |
|
1 |
5 |
14,0 |
0,28 |
|
2 |
5 |
8 |
0,16 |
|
3 |
5 |
3,2 |
0,064 |
|
4 |
5 |
1,6 |
0,032 |
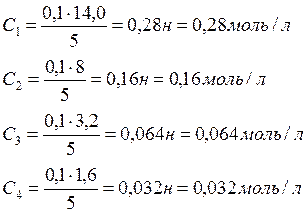
3. Вычисление убыли концентрации
кислоты в каждом растворе ![]() и
количества адсорбированного вещества по формуле
и
количества адсорбированного вещества по формуле 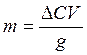 ,
где g – навеска адсорбента (g=3г), г; V – объём раствора, см3.
,
где g – навеска адсорбента (g=3г), г; V – объём раствора, см3.
|
№ |
Концентрация раствора, моль/л |
Убыль концентрации кислоты, моль/л |
m, моль/кг |
С/m |
lgC |
lgm |
1/С |
1/m |
|
|
исходная |
равновесная |
||||||||
|
1 |
0,4172 |
0,28 |
0,1372 |
2,28 |
0,12 |
-0,55284 |
0,359203 |
3,57 |
0,44 |
|
2 |
0,2086 |
0,16 |
0,0486 |
0,81 |
0,19 |
-0,79588 |
-0,09151 |
6,25 |
1,23 |
|
3 |
0,1043 |
0,064 |
0,0403 |
0,67 |
0,09 |
-1,19382 |
-0,17285 |
15,63 |
1,49 |
|
4 |
0,0521 |
0,032 |
0,0201 |
0,335 |
0,09 |
-1,49485 |
-0,47496 |
31,25 |
2,99 |
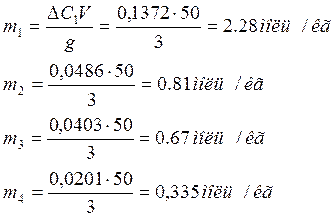
4. Изотерма адсорбции в координатах m=f(C). Закон Генри (“область Генри”).
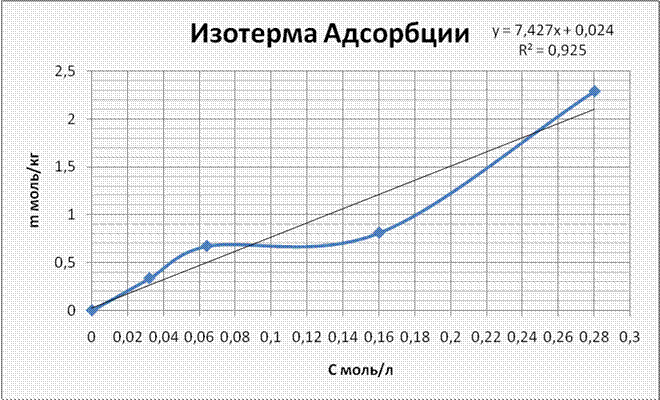
Удельная
адсорбция увеличивается с ростом концентрации раствора, а в бесконечно
разбавленных растворах ![]() данная
зависимость носит прямолинейный характер (“область Генри”), и адсорбция
подчиняется закону Генри m=KC. Таким образом можно вычислить
константу Генри:
данная
зависимость носит прямолинейный характер (“область Генри”), и адсорбция
подчиняется закону Генри m=KC. Таким образом можно вычислить
константу Генри:
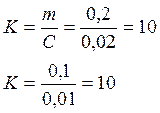
5. Изотерма адсорбции в координатах lgm=f(lgC). Уравнение Фрейндлиха.
![]()
![]()
![]()
![]()
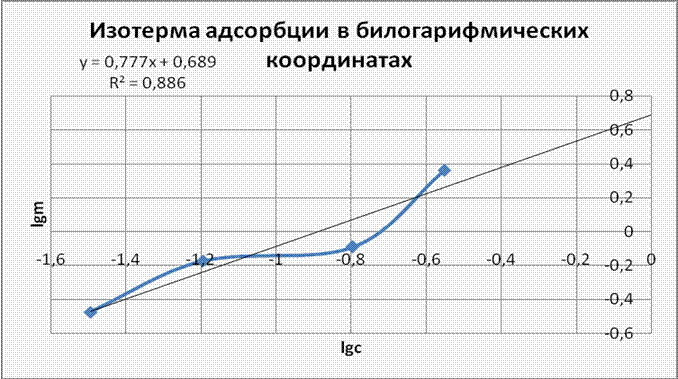
Проверка применимости уравнения Фрейндлиха m=aC1/n и определение его постоянных:
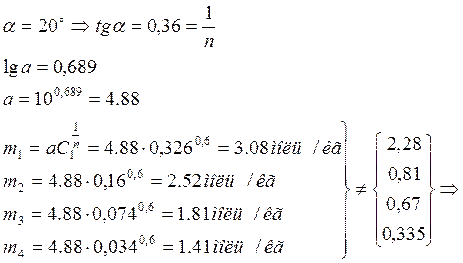
![]() уравнение
Фрейндлиха не применимо, так как результаты опытов не согласуются с
результатами, полученными при расчёте.
уравнение
Фрейндлиха не применимо, так как результаты опытов не согласуются с
результатами, полученными при расчёте.
6. Изотерма адсорбции в координатах С/m=f(C). Уравнение Ленгмюра.
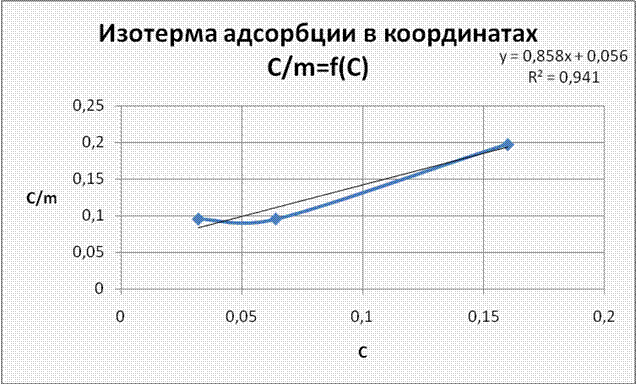
Проверка
применимости уравнения Ленгмюра 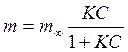 (где
(где
![]() -
предельная адсорбция) и определение его постоянных:
-
предельная адсорбция) и определение его постоянных:
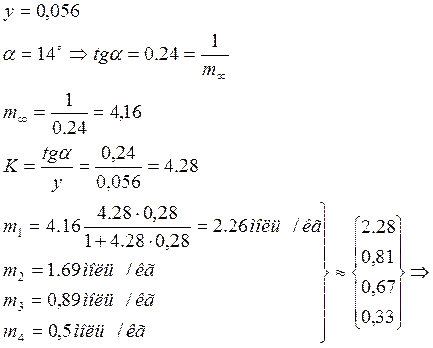
![]() уравнение
Ленгмюра применимо отклонения обусловлены погрешностью измерения.
уравнение
Ленгмюра применимо отклонения обусловлены погрешностью измерения.
7. Удельная поверхность активированного угля:
![]() ,
где
,
где ![]() -
число Авогадро, 1/моль;
-
число Авогадро, 1/моль; ![]() -
площадь поперечного сечения молекулы адсорбента, равная для карбоновых кислот
примерно 20,5*10-20м2.
-
площадь поперечного сечения молекулы адсорбента, равная для карбоновых кислот
примерно 20,5*10-20м2.
![]()
Вывод: опыт показал, что полученные данные не применимы для уравнения Фрейндлиха, но в принципе применимы для уравненияия Ленгмюра. Тогда, определив предельную адсорбцию, можно приближённо оценить удельную поверхность активированного угля, применяемого в качестве адсорбента.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.