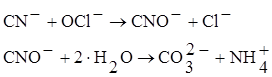
В качестве окислителя используется кислород воздуха, озон, хлор, хлорная известь, гипохлорит. Наибольшее распространение на обогатительных фабриках в качестве окислителя получили газообразный хлор и его соединения (как самые дешевые).
Осаждение – перевод растворимой примеси в твердый осадок в виде какого-либо трудно-растворимого соединения. Например, ионы ртути удаляют из сточных вод осаждением сульфидом натрия. Ртуть при этом выделяется из раствора в виде осадка сульфида ртути.
Зная природу растворенной примеси можно всегда подобрать условия и соответствующий реагент, чтобы осадить ее из раствора. Целью настоящей работы является изучение процесса очистки воды от ионов тяжелых цветных металлов на примере меди.
Очистка раствора от ионов меди производится нейтрализацией. В качестве нейтрализатора используется сухая негашеная известь (CaO).
Отмерить мензуркой 100 мл исходного раствора с заданной концентрацией сульфата меди. Перенести их в стеклянный стакан и замерить исходное pH раствора. Измерение pH производится на pH-метре И-130. Исходную концентрацию ионов меди в растворе узнать у преподавателя.
Затем стакан с раствором ставится на магнитную мешалку. Взвешивается 1 г извести, готовятся конические колбы и воронки с фильтром.
При включенной мешалке в раствор дробно (на кончике шпателя) подается известь. После перемешивания в течение 5 минут стакан снимается с мешалки, замеряется pH и отбирается проба 5 мл для анализа. Проба отбирается в коническую колбу через воронку с фильтром. Фильтр предварительно смачивается дистиллированной водой. По мере фильтрации фильтр несколько раз промыть водой. Стакан с исследуемым раствором вновь ставится на мешалку, и добавка извести повторяется и т.д.
Всего проводится добавок извести до тех пор, пока pH раствора не достигнет 9¸9,5.
Отобранные пробы анализируются на содержание меди. Для этого в пробу добавляется несколько капель раствора серной кислоты (из капельницы), немного сухого йодистого калия (шпателем) и несколько капель раствора крахмала. Раствор окрасится в синий цвет. После этого титровать раствор 0,1 н. раствором гипосульфита натрия (Na2S2O3) до полного обесцвечивания раствора. Содержание меди в растворе определяется по формуле, г/л:
![]() , где
, где
Т – титр гипосульфита по меди, Т=0,003177 г/мл; V – объем гипосульфита натрия, пошедшего на титрование, мл; a – объем отобранной пробы, мл.
По полученным данным строится график зависимости концентрации меди в растворе от pH раствора и делается вывод о возможной глубине очистки раствора от ионов меди известью.
РЕКОМЕНДАТЕЛЬНЫЙ БИБЛИОГРАФИЧЕСКИЙ СПИСОК.
1. Чуянов Г.Г. Обезвоживание, пылеулавливание и охрана окружающей среды. М., Недра, 1987.
2. Справочник по обогащению руд. Специальные и вспомогательные процессы, испытания обогатимости, контроль и автоматика. М., Недра, 1983.
СОДЕРЖАНИЕ
|
Ввение¼¼¼……………………………………………………... |
3 |
|
Работа 1. Исследование влияния коагулянтов и флокулянтов на сгущаемость рудной пульпы……………………………... |
4 |
|
Работа 2. Определение постоянных в основном уравнении фильтрации……………………………………………………….. |
9 |
|
Работа 3. Исследование работы осадительной центрифуги………. |
15 |
|
Работа 4. Очистка воды от ионов тяжелых цветных металлов….… |
19 |
|
Рекомендательный библиографический список…………………….. |
22 |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.