















ГЛАВА 6 ТЕРМОДИНАМИКА РЕАЛЬНОГО ГАЗА
Фазовые переход – переход веществ из одной фазы в другую, сосуществующую с первой. Вещество в различных агрегатных состояниях имеет различные физические свойства, и в частности плотность.
При переходе вещества из жидкого состояния в газообразное теплота фазового перехода тратится как на работу расширения так и на преодоление сил межмолекулярного взаимодействия, которые выражаются в разрушении ассоциированных комплексов. Плотность уменьшается. При плавлении и сублимации теплота фазового перехода тратится на разрушение кристаллической решётки.
С увеличением р и Т теплота парообразования уменьшиться. Фазовый переход из твёрдой фазы в газообразную, происходит при очень низких давлениях, называется сублимацией. Теплота сублимации больше чем теплота парообразования или плавления.
Плотность газовой фазы меньше плотности конденсированной (или твердого вещества) фазы. Что касается плавления, то для различных веществ возможны различные случаи: плотность твёрдой фазы может быть либо больше либо меньше плотности жидкости. Точка перехода жидкости в пар называется точкой кипения (точка конденсации), точка перехода твёрдого тела в жидкость-точка плавления (точка затвердевания); твёрдого тела в пар-точка сублимации.
При анализе фазовых равновесий и процентов фазовых переходов важную роль играет так называемое правило фаз Гиббса. Оно устанавливает зависимость между числом независимых интенсивных переменных, определяющих состояние термодинамической системы, находящейся в равновесии (или степени свободы системы), числом фаз и числом компонентов системы
ψ= n−r+2, (6.1) где: ψ − число степеней свободы; n − число компонентов системы; r − число фаз в системе. Применение к чистому веществу (однокомпонентная система): ψ=3−r .
Для чистых веществ в однофазной системе ψ=2. Такими независимыми переменными могут быть, например, р и Т. Это значит, что если для такой системы произвольно задать давление и температуру, то все другие параметры системы (V,s,h и т.д.) будут определены однозначно.
Линию фазового перехода можно изобразить в диаграмме р-Т, если нанести на неё состояние, соответствующее давлениям и температурам фазового перехода (рис.6.1).
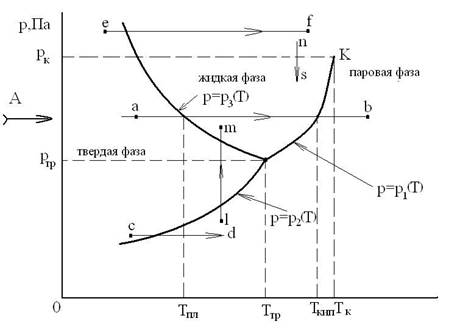
Рис. 6.1. р-Т диаграмма фазовых переходов
Равновесное существование 3-х фаз возможно только при определенных давлении ртр и температуре Ттр. Это состояние термодинамической системы называется тройной точкой, и что число степеней ее свободы равно нулю.
Для двухфазной термодинамической системы существует однозначная зависимость р=р(Т), т.е. термодинамическая система обладает одной степенью свободы.
В однофазной термодинамической системе независимо могут изменяться два термодинамических параметра: давление р и температура Т (система обладает двумя степенями свободы).
На фазовой р-Т диаграмме линия р=р1(Т) является кривой парообразования (испарения), на которой сосуществуют, т.е. находятся в равновесии, жидкая и паровая фазы.
Линия – р=р2(Т) - это кривая сублимации, на которой находятся в равновесии твердая и паровая фазы. При этом подводятся энергия, равная теплоте сублимации.
Линия р=р3(Т) - кривая плавления, на которой находятся в равновесии твердая и жидкая фазы.
Кривая парообразования р=р1(Т) оканчивается для каждого вещества в точке К при определенных критических значениях давления рк и температуры Тк.
При критическом состоянии вещества пропадает различие между свойствами жидкости и пара.
Кривые р1(Т), р2(Т) и р3(Т) разграничивают плоскость диаграммы р-Т на области, соответствующие паровой, жидкой и твердой фазам. Рассмотрим характерные процессы, представленные на р-Т диаграмме:
- «a-b» – изменение агрегатного состояния вещества: плавление при
Тпл и парообразование при Тs=Ткип. При этом свойства вещества изменяются скачком:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.