Увеличение температуры реакционной зоны в два раза может привести к увеличению скорости в 5×108 раза
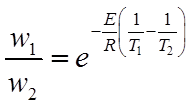 ,
(3.11)
,
(3.11)
где w1 - скорость химической реакции при температуре T1=500 К; w2 - то же, при Т2 = 1000 К и Е = 168×103 кДж/моль.
Зависимость константы скорости реакции от давления среды, где протекает процесс определяется выражением:
k~ pn-1 (3.12)
где р – давление окружающей среды; n - порядок химической реакции. Мономолекулярные реакции не зависят от давления; бимолекулярные - k~ p; тримолекулярные - k ~ p2.
Развитие и скорость цепной реакции, температура в реакционной зоне ограничиваются присутствием замедлителей - ингибиторов, к которым относятся и инертные газы (например, молекулярный азот). Замедлителями скорости реакции в топочной камере это, прежде всего, «холодные» поверхности нагрева, и другие препятствия активному взаимодействию реагирующих компонентов (молекул).
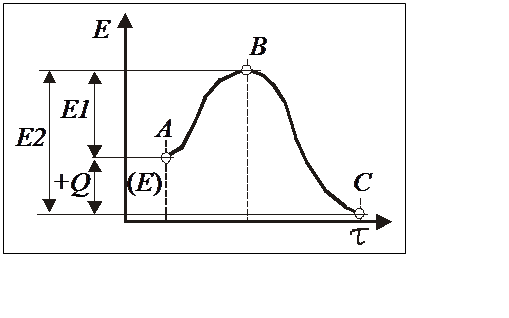
Рис. 3.4. Схема влияния энергии активации на тепловой эффект химических реакций
Если энергия активации Q (Е) меньше энергии полученной в процессе реакции Е2, то такие реакции называются экзотермические (т.е. идущие с выделением теплоты). В случае когда Е> Е1 реакции идут с поглощением теплоты – эндотермические (например реакции диссоциации).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.