Подразумевается, что синтез материалов в предполагаемых для практического использования температурных и прочих условиях выполнения процесса осаждения термодинамически определенно возможен. В связи с этим вопросы термодинамики вынесены за рамки настоящих лекций. Однако важным является то, что термодинамические оценки дают возможность предсказывать получение продукта химической реакции безотносительно его состояния. Например, основной продукт окислительной реакции SiH4 + O2 → SiO2 (+ побочные продукты) в зависимости от конкретных условий может быть либо в виде порошка аэросила (мелкодисперсного диоксида кремния) или тонкого слоя диоксида кремния см. рис.2.3. Однако присутствие даже малых следов аэросила на подложке с микросхемами является абсолютно неприемлемым для технологии ИМС. Поэтому, задача исследователя и технолога состоит в том, чтобы найти условия и осуществить реализацию процесса в направлении получения тонкого слоя высокого качества.
 В
В
Рис.2.3. Области роста слоев диоксида кремния и образования аэросила в системе реагентов SiH4-O2 в координатах температура-давление
В этой связи, процесс ХОГФ получения высококачественного тонкого слоя является строго управляемым и оптимизированным химическим синтезом. Образование тонкослойных материалов при ХОГФ происходит в результате гетерогенных химических реакций. Следовательно, закономерности таких процессов следует описывать в рамках химической кинетики, рассматривая это явление как сложные гетерогенные реакции, протекание которых определяется процессами в газовой фазе и превращениями на растущей поверхности тонкого слоя, см. рис.2.4.
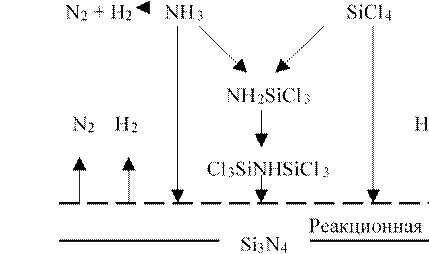
Рис.2.4. Стадийность и маршруты превращения при образовании слоев нитрида кремния в системе реагентов SiCl4-NH3: исходные вещества, промежуточные продукты, конечные основной и побочные продукты.
2.4. Химические реакции
В основе процессов ХОГФ кремнийсодержащих слоев, позволяющих получать разнообразие указанных выше тонкослойных материалов, лежат несколько типов химических реакций. Важнейшие реакции расшифрованы на примерах схем реакций в табл.2.2. Из них в технологии ИМС наиболее востребованными оказались первые три типа реакций: реакции пиролиза, окисления, аммонолиза.
Подчеркнем, что применительно к процессам ХОГФ приведенные в табл.2.2 схемы реакций общеприняты. Однако они достаточно условны. Дело в том, что состав побочных продуктов реакций зависит от конкретных условий процесса ХОГФ. Например, побочным продуктом окислительных реакции гидридов (моносилан, фосфин, диборан) при ХОГФ в зависимости от конкретных условий могут быть и водород, и вода. Поэтому, использовать такие схемы в каких-либо расчетах можно только с определенными допущениями.
Таблица 2.2
|
Тип |
Пример реакции |
|
Пиролиз |
Ni(CO)4 → Ni + 4CO SiH4 → Si + 2H2 Si(ОС2Н5)4 → SiO2 + 4С2Н4 + 2Н2О |
|
Окисление |
SiH4 + O2 → SiO2 + 2H2 4PH3 + 5O2 → 2P2O5 + 6H2 2B2H6 + 3O2 → 2B2O3 + 6H2 SiH4 + 4N2O → SiO2 + 2H2O + 4N2 SiH2Cl2 + N2O → SiO2 + 2N2 + 2HCl |
|
Аммонолиз |
3SiH4 + 4NH3 → Si3N4 + 12H2 3SiH2Cl2 + 10NH3 → Si3N4 + 6NH4Cl + 6H2 3SiCl4 + 16NH3 → Si3N4+ 12NH4Cl B2H6 + 2NH3 → 2BN+ 6H2 |
|
Восстановление |
SiCl4 + H2 → Si + HCl WF6 + 3H2→ W + 6HF |
|
Гидролиз |
TiCl4 + 2H2O → TiO2 + 4HF SiF4 + 2H2O → SiO2 + 4НF |
|
Взаимодействие с метаном |
SiCl4 + CH4 → SiC+ 4HCl |
|
Взаимодействие с моносиланом |
2MoCl5 + 4SiH4 → 2MoSi2 + 10HCl + 3H2 |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.