СИЛИКАТЫ — солеобразные химич. соединения, содержащие кремнезем 8Юд, играющий кислотную роль. Природные С. — важнейший класс минералов. С. отличаются весьма разнообразным составом. Так, в природных С. наряду с Si44 содержится 1, 2, 3 и более катионов: Ti4-, Zr4+, Al3, W+, Cтз+, В3, Ca2, Mg2, Ре2 Мп2, Ве2, Na+, K+, Ы+ и др. В составе С. могут быть добавочные (не связанные с Si^) анионы: О2-, OH-,F-, C1-, СО2,-, SO – и др. Вода в С. может содержаться как в виде ионов ОН-, входящих в решетку (конституционная вода), так и в виде молекул Н^О (кристаллизационная вода) — в минералах группы цеолитов.
Свойства С. определяются как их составом и родом сил, действующих между ионами, так и строением кристаллич. решеток, их дефектностью. Плотность С. колеблется от 2 до 4, иногда выше. С. обладают различной окраской, обусловленной наличием окрашенных катионов — W+, Fe^, Ni2+, Mn2+, Cu^Cr^ и др., а также углерода. В тонких слоях С. прозрачны, часто они имеют стеклянный блеск. Твердость их колеблется от 1 (тальк, каолинит), чаще же до 6—7 в среднем (муллит, силлиманит, форстерит). При нагревании С. либо плавятся — конгруентно или ин-конгруентно, либо разлагаются в твердом состоянии, иногда с выделением летучих компонентов. Темп-ры плавления колеблются от небольших, напр. 874° (Nai,0.2Si02), 770° (K^O^SiO;,), до, напр., 2130° (2CaO.SiOa), 1890° (2MgO.SiO„).
Решение вопроса о конституции С. было достигнуто на основании рентгеноструктурного анализа. Эти работы, охватившие гл. обр. С. с мелкими катионами, особенно Mg2+, Fe2+и АР+, за рубежом были выполнены (начиная с 1926) В. Л. Брэггом, Л. Полин-гом и Ф. Махачки и др. Начиная с 1952, преимущественно в СССР Н. В. Беловым, была развита кристаллохимия С. с крупными катионами (особенно Na+,
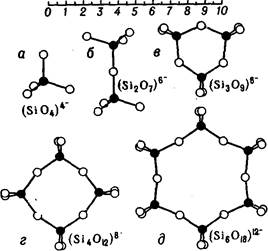 |
Рис. 1. Островной тетраэдр и сложные конечные группы из тетраэдров [SiOJ.
Са^ и редкоземельных элементов) в отсутствии или при наличии одновременно более мелких катионов. В основе строения С. с мелкими катионами лежит тетраэдрич. ортогруппа [Si04]4- (см. рис. 1,а) с Si4 в центре и 402 в вершинах тетраэдра с ребрами длиной ~2,6А. Полиэдры из катионов (кроме 8г'+) в центре и ионами О2- в вершинах соизмеримы по величине ребер с тетраэдрами [8104] (рис. 2). Тетраэдры в С. могут соединяться через общие кислородные вершины в кремнекйб-лородные комплексы. Каждые два соседних тетраэдра имеют одну общую вершину. С уменьшением атомного отношения 0/Si в составе С. число тетраэдров в комплексе растет (см. таблицу).
|
|
Рис. 2. Взаимосвязь метасили" катных цепочек [SiO,] ® и лент из октаэдров вокруг основных катионов: а — в пироксенах;
тетраэдры [SiOJ — черные треугольники, октаэдры мелких катионов заштрихованы; б — в пироксеноидах; тетраэдры [SiOJ и диортогруппы заштрихованы, октаэдры крупных катионов оставлены белыми.
При O/Sis'4 они непосредственно друг с другом не соединяются (рис. 1,а, группа А), при 0/Si==3 они образуют замкнутые шестерные кольца из 3, 4 или 6 тетраэдров (рис. 1, в, г, 9, группа Б, б) либо цепочки (рис. 3, а, в, д, группа В, а). При 0/Si=2,5 из тетраэдров возникают слои, сетки или листы (рис. 4, 5, группа В, в). Если 0/Si=2, то образуются
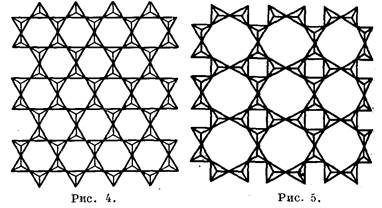 |
Рис. 4. Плоская кремнекислородная сетка с шестерными кольцами из тетраэдров [SiO,], продукт конденсации пи-роксеновых цепочек (в) через амфиболовые ленты (г), рис. 3.
Рис. 5. Продукт конденсации пироксеноидных цепочек через ксонотлитовые ленты в идеальную апофиллитовую сетку.
трехмерные радикалы — вязаные или каркасны структуры (напр., рис. 6, группа Г).
Тетраэдры [SiO^I или комплексы из них, в ком рых имеются ионы О2- с ненасыщенными зарядам соединяются друг с другом через основные катиона
Катион Al°+ может располагаться между 4 кислоро-дами в тетраэдре [А1С>4] и тогда играет кислотную роль (алюмосиликаты), либо между 6 кисло родами в октаэдре [Aide] и тогда играет роль основания (С. алюминия). Лишь изредка образуются группы fAlOJ. Тетраэдры [A1C>4] чаще возникают в присутствии щело- ] чей (напр., в полевых шпатах) и совместно с [S'iO^] образуют общие алюмокремнийкис-лородные комплексы.
|
|
Рис. 6. Кремнекислород-ный каркас в структуре ромбоэдрич. шабазита. Показаны лишь Si-ионы в центрах тетраэдров, сцеплющихся в двухэтажные шестерные кольца — призмы. Штрихованные квадраты — места примыкания гексагопальных призм к обширной центральной полости. Большие восьмер- , ные кольца — окна, соединяющие соседние полости, обеспечивают прохождение и абсорбцию дфупных молекул с диаметром до ~5А.
В боросиликатах ~BЗ+ занимает в тетраэдрах положение, сходное с АР+ в алюмосиликатах.
У С. с крупными катионами структурной единицей часто служат
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.