Министерство образования Российской Федерации
Санкт-Петербургский Государственный Горный Институт

Кафедра металлургии цветных металлов
Отчет по лабораторной работе
Выщелачивание цинкового огарка.
Выполнил: студент группы МЦ-01
Якубаускас И.В.
Проверил: доцент кафедры .МЦМ.
Орлов А.К.
Санкт-Петербург
2004
1.Цель работы- исследовать поведение различных компонентов при сернокислотном выщелачивании.
2. Краткие теоретические сведения.
Цинковый огарок состоит в основном из оксидов металлов в свободном виде. В небольшом количестве в нем присутствуют сульфиды, сульфаты, а также ферриты, силикаты, алюминаты и другие соединения металлов.
При обработке огарка серной кислотой в раствор, наряду с цинком, могут переходить и некоторые другие металлы, которые отрицательно влияют на выделение цинка из раствора электролизом. Максимально перевести цинк из огарка в раствор и минимально перевести в него примеси – не представляется возможным, поэтому обычно выщелачивание проводят в две стадии: нейтральное и кислое выщелачивание.
Основной задачей нейтрального выщелачивания является гидролитическая очистка раствора от примесей, основанная на различии равновесных значений рН образования гидратов цинка и металлов – примесей. Цинк при этом переходит в раствор лишь частично, около 70-75% от количества его в огарке. С целью максимального перевода цинка в раствор проводят кислое выщелачивание твердого остатка после нейтрального выщелачивания. Переходящие при этом в раствор вместе с цинком примеси выводят из него частично в процессе нейтрального выщелачивания, куда попадают растворы из кислого цикла.
На скорость процесса выщелачивания цинкового огарка влияют интенсивность перемешивания пульпы, концентрация кислоты в растворе, температура пульпы, размеры, пористость и химическая активность частиц огарка.
3.Задание:
Необходимо провести кислое выщелачивание 40 г цинкового огарка,
1,28% меди,
1,40% свинца,
0,20% кадмия,
9,24% железа,
57,71% цинка.
Выщелачивание проводят при соотношении Т:Ж=1:10 и расходе серной кислоты 90% от стехиометрии (концентрация серной кислоты С=910г/л).
Решение. Сначала рассчитываем стехиометрически необходимое количество на растворение металлов по реакции:
![]() .
.
На растворение цинка, меди, свинца и кадмия нужно соответственно:
Zn: 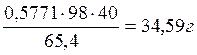
Сu: 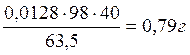
Pb: 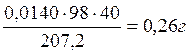
Cd: 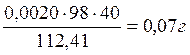 .
.
Всего: 34,59+0,79+0,26+0,07=35,71 г кислоты.
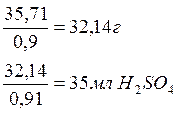
4. Результаты эксперимента.
|
Время от начала опыта, мин |
Концентрация в растворе, г/ см3 |
Извлечение цинка в р-р, % |
|||
|
Cu |
|
Fe2+ |
Fe3+ |
||
|
0 |
0,00 |
98 |
0,00 |
0,00 |
0 |
|
5 |
0,90 |
7,1 |
0,33 |
- |
- |
|
10 |
0,93 |
1,4 |
0,15 |
- |
- |
|
20 |
1,50 |
pH=5 |
0,11 |
- |
- |
|
40 |
0,80 |
pH=5 |
0,09 |
0,02 |
91,8 |
![]()
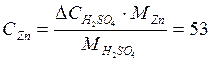
Извлечение цинка в раствор (в процентах)
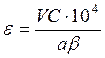 ,
где
,
где
V – объем раствора при выщелачивании, дм3
С – концентрация цинка в растворе, , г/ дм3
a – масса огарка, г
![]() -
содержание цинка в огарке, %
-
содержание цинка в огарке, %
Приведем результат вычисления извлечения цинка в раствор на 5 минуте эксперимента, остальные значения рассчитываются аналогично.
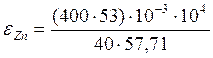 =91,6%.
=91,6%.
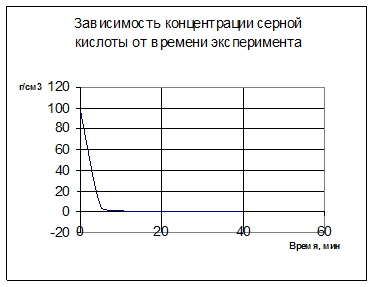
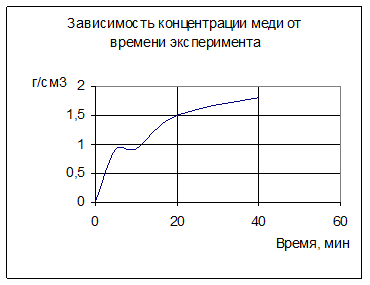
Вывод: В ходе эксперимента концентрация серной кислоты резко падает, вследствие её реакционоспособности. Этим же и объясним рост концентрации меди в растворе при выщелачивании (медь за счет высокой концентрации серной кислоты переходит в сульфатную растворимую форму). Нейтральное выщелачивание …..
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.