


Новосибирский государственный университет
Лабораторная работа по химической кинетике
Тема: Изучение кинетики реакции йодирования ацетона
спектрофотометрическим методом
Выполнили:
Студенты 742 группы
Казакова Юлия
Рыбин Вячеслав
Новосибирск 2010
Теоретическая часть.
Цель работы: Определение порядков реакции по реагентам.
Реакция йодирования ацетона
CH3COCH3+I2→CH2COCH2I+HI
Идет с заметной скоростью как в кислой, так и в щелочной средах. Механизм этой реакции в этих средах различен. В растворе сильных кислот в водной среде схема реакции может быть представлена в виде:
CH3COCH3+H3O+↔ CH3C(OH)CH3++H2O (быстро)
CH3C(OH)CH3++H2O↔ CH3COCH3 (енольная форма) +H3O+ (медленно)
CH3COCH3 (енольная форма) +I2→CH2COCH2I+HI (быстро)
Было доказано, что эффективная константа скорости Кэф не зависит от концентрации йода и не изменяется при замене йода на бром. Вместе с тем скорость реакции прямо пропорциональна концентрации ионов H3O+. Это отвечает механизму, в котором общая скорость реакции определяется процессом енолизации ацетона. В этом случае скорость реакции равна:
W=K2[CH3C(OH)CH3+][H2O]
Учитывая, что константа равновесия протонирования ацетона равна:
Kp=[CH3C(OH)CH3+][H2O]/[CH3COCH3][H3O+]
Тогда выражение для скорости реакции нетрудно привести к виду
W=KрK2[CH3COCH3][H3O+]
В этом случае эффективная константа скорости равна
Кэф=KрK2
Кинетические исследования проводят спектрофотометрическим методом.
Определение порядков реакции по реагентам и энергии активации реакции.
Данная реакция является примером медленно идущей реакции, поэтому для неё хорошо применим метод расчета по начальной скорости. Хотя концентрация йода не входит в кинетическое уравнение, кинетику удобно исследовать именно по убыли йода, применяя спектрофотометрический метод. Обозначим начальные концентрации ацетона и ионов водорода соответственно СА СН. Тогда скорость реакции с учетом уравнения запишется в виде
W=dP/dt=Kоп(СА-[P])(СН+[P])=KопСАСН(1-[P]/СА)(1+[P]/СH)
Где [P]-концентрация образующегося продукта-йодацетона.
Если начальные концентрации реагентов выбраны так, что начальная концентрация йода значительно меньше, чем начальные концентрации остальных реагентов, то в этом случае скорость реакции можно представить в виде
W=KопСАСН
Отсюда
Kоп=W/САСН
Поскольку в ходе реакции происходит расходование йода, то скорость реакции удобно измерять по изменению оптической плотности D раствора на длине волны поглощения йода:
W=-1/(l ε)*(dD/dt)
Тогда
Kоп=-1/(l εСАСН )*(dD/dt) (1)
Таким образом, для определения Kоп нужно изучить зависимость D от t в начальный период реакции и определить угловой коэффициент (dD/dt).
Экспериментальная часть:
При фотометрировании используют длину волны λ = 410нм.
А – точный раствор йода с концетрацией 1,1*10-3 (1,097*10-3)
Для этого навеску йода (0,0557г) растворили в колбе на 200мл в небольшом количестве 10%-ого раствора KI, довели до метки.
В – титрованный раствор соляной кислоты с концентрацией 1,0000 М.
Измерили оптическую плотность растворов, относительно воды. Из экспериментальных данных проверили закон Бугера –Ламберта-Бера:
D=E*L*C
При λ = 410нм, L = 1см.
|
D |
С,моль/л |
E |
|
0,178 |
0,5*10-4 |
3560 |
|
0,371 |
1,0*10-4 |
3710 |
|
1,977 |
5,0*10-4 |
3954 |
Из уравнения прямой находим коэффициент экстинкции: Е=3741,33 л/моль*см-1
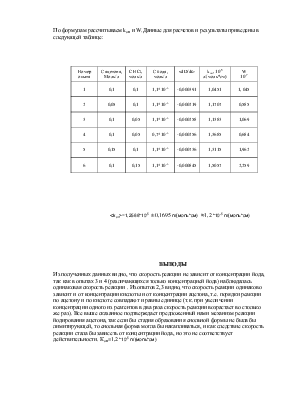
По формулам рассчитываем kоп и W.Данные для расчетов и результаты приведены в следующей таблице:
|
Номер опыта |
C ацетона, Моль/л |
C HCl, моль/л |
C йода, моль/л |
<dD/dt> |
kоп, 10-5 л/(моль*см) |
W 10-7 |
|
1 |
0,1 |
0,1 |
1,1*10-4 |
-0,000391 |
1,0451 |
1, 045 |
|
2 |
0,05 |
0,1 |
1,1*10-4 |
-0,000219 |
1,1707 |
0,585 |
|
3 |
0,1 |
0,05 |
1,1*10-4 |
-0,000258 |
1,1383 |
1,069 |
|
4 |
0,1 |
0,05 |
0,7*10-4 |
-0,000256 |
1,3685 |
0,684 |
|
5 |
0,15 |
0,1 |
1,1*10-4 |
-0,000736 |
1,3115 |
1,962 |
|
6 |
0,1 |
0,15 |
1,1*10-4 |
-0,000845 |
1,5057 |
2,259 |
<kоп>=1,2566*10-5 ± 0,1695 л/(моль*см) ≈ 1,2*10-5л/(моль*см)
ВЫВОДЫ
Из полученных данных видно, что скорость реакции не зависит от концентрации йода, так как в опытах 3 и 4 (различающихся только концентрацией йода) наблюдалась одинаковая скорость реакции . Из опытов 2,3 видно, что скорость реакции одинаково зависит и от концентрации кислоты и от концентрации ацетона, т.е. порядки реакции по ацетону и по кислоте совпадают и равны единице (т.к. при увеличении концентрации одного из реагентов в два раза скорость реакции возрастает во столько же раз). Все выше сказанное подтверждает предложенный нами механизм реакции йодирования ацетона, так если бы стадия образования енольной формы не была бы лимитирующей, то енольная форма могла бы накапливаться, и как следствие скорость реакции стала бы зависеть от концентрации йода, но это не соответствует действительности. Коп=1,2*10-5л/(моль*см)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.