Новосибирский Государственный Университет
Кафедра физической химии
Лабораторная работа К-I
Кондуктометрическое титрование.
Выполнил:
Новосибирск 2006 г.
Теоретическая часть.
Механизм электропроводности.
Если к электродам приложено
напряжение V, то на заряженную частицу, находящуюся
между электродами, будет действовать сила ![]() ,
равная:
,
равная:
![]() (1)
(1)
Сила вызывает перемещение частицы в направлении поля со скоростью V Рассматривая частицу как шарик, двигающийся в сплошной вязкой среде, можно применить уравнение Стокса:
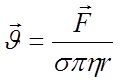 (2)
(2)
где η – вязкость растворителя, r – радиус иона. Согласно (2), частица, находящаяся в вязкой среде под действием постоянной силы приобретает постоянную скорость, пропорциональную приложенной силе. Для одномерного случая из (1) и (2) имеем:
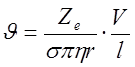 (3)
(3)
где l – расстояние между электродами, а V/l – средний градиент потенциала.
Формула (3) выполняется только для ионов большого размера. Если размеры иона и молекул растворителя близки, то растворитель уже нельзя считать сплошной средой. В этом случае предполагается “дырочный” механизм проводимости. Считается, что находящиеся перед ионом молекулы растворителя расходятся в стороны, образуется дыра (вакансия), в которую затем перескакивает ион. Согласно этим представлениям перемещение частицы происходит путём активированных скачков из одного положения равновесия в другое.
Рассмотренный случай отвечает нормальному типу проводимости.
Однако часто наблюдается другой, аномальный механизм проводимости – механизм Гротгуса. Так в водных растворах кислот заряд перемещается по цепочке водородных связей. При этом связи H···O превращаются в нормальные связи H-O, нормальные связи вдоль пути перемещения заряда превращаются в водородные и справа появляется новый ион водорода H+. Входивший ранее в крайнюю левую молекулу воды. Таким образом, осуществляется быстрый перенос заряда на большие расстояния.
Основные понятия в кондуктометрии (сопротивление раствора, проводимость, удельная проводимость, постоянная ячейки, эквивалентная проводимость, ионная проводимость, числа переноса).
В кондуктометрическом методе непосредственно измеряемыми величинами являются либо сопротивление раствора – R, выражаемое в Омах, либо величина обратная сопротивлению R-1 – проводимость раствора.
Сопротивление раствора зависит от его удельной электропроводности χ и геометрической формы сосуда, в котором проводятся измерения. В простейшем случае цилиндрического сосуда:
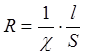 (4)
(4)
где S – сечение столба жидкости в см2, l – расстояние между электродами в см. Из (4) следует, что χ выражается в Ом-1см-1. Для сосуда любой произвольной формы влияние геометрического фактора можно учесть, если известна зависимость S=S(l):
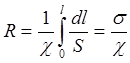 (5)
(5)
Величина σ, учитывающая форму сосуда, но независящая от χ, называется постоянной сосуда (ячейки).
Постоянную сосуда обычно определяют косвенным путём. С этой целью измеряют сопротивление данной ячейки со стандартным раствором, удельная электропроводность которого известна заранее. Тогда:
![]() (6)
(6)
В качестве стандартных растворов используют 0,1 н. и 0,01 н. водные растворы KCl при 25°C:
Χ0.1=0.01289 Ом-1см-1
Χ0.01=0.001411 Ом-1см-1
Удельная электропроводность раствора складывается из удельной электропроводности чистого растворителя χ0, и удельной электропроводности растворённого вещества (χ- χ0). Величина χ- χ0 тем больше, чем больше концентрация растворённого вещества. Отношение χ- χ0 к концентрации вещества m в эквивалентах на см3 раствора, называется эквивалентной электропроводимостью и обозначается Λ:
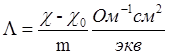 (7)
(7)
Переходя к концентрации m экв/литр, имеем:
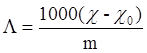 (8)
(8)
Эквивалентная электропроводность характеризует способность вещества проводить ток. Она зависит от скорости движения частиц, степени диссоциации вещества и, в общем случая, является функцией концентрации.. если при растворении вещества не образуются иона, то Λ=0.
Эквивалентную электропроводимость можно представить в виде суммы ионных электропроводимостей λi . Для 1,1-валентного электролита:
![]() (9)
(9)
где λ+ - относиться к катиону, а λ- - к аниону. Используя ионные электропроводности представим (9) в виде:
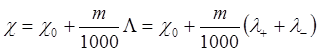 (10)
(10)
Обобщая (9) на случай любого электролита, имеем:
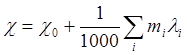 (11)
(11)
где mi – концентрация i-го иона в экв. на литр, λi – его ионная проводимость в расчете на одни эквивалент-ион (например, грамм-ион Ca++ равен двум эквивалент-ионам 1/2Ca++, именно к таким условным единицам отнесены справочные данные по многозарядным ионам) При этом заряды ионов в явном виде в формулу 11 не входят.
Относительный вклад i-го иона в электропроводность раствора называется числом переноса данного иона и обозначается ti:
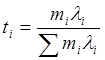
Число переноса – безразмерная величина, сумма по всем ионам:
![]()
В случай 1,1-валентного электролита в силу условия электронейтральности m+=m- и
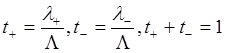
где t+ и t- - числа переноса катиона и аниона, соответственно электропроводность электролитов связана со скоростями движения ионов в растворе. Скорость движения ионов в растворе Vi [м·с-1] пропорциональна напряжённости приложенного электрического поля E [В·м-1].
![]()
Коэффициент пропорциональности Wi [м2с-1В-1] называется подвижностью иона. Ионная проводимость пропорциональна подвижности иона. При степени диссоциации α=1 коэффициент пропорциональности – постоянная Фарадея (96500 Кл/г-экв)
![]()
![]()
Тогда число переноса запишется:
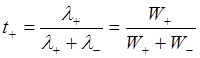 ,
, 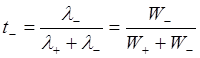
Применение закона Стокса к кондуктометрии даёт:
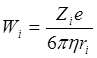
Экспериментальная часть.
Цель: определение концентрации HCl титрованием по KOH; оценка ионных
электропроводностей ![]() и
и ![]() ,
эквивалентные электропроводности
,
эквивалентные электропроводности ![]() и
и ![]() по экспериментальным данным , подвижности
ионов
по экспериментальным данным , подвижности
ионов ![]() и
и ![]() , числа
переноса OH- и H+
в растворах HCl и KOH и радиусы
ионов K+ и Cl-.
, числа
переноса OH- и H+
в растворах HCl и KOH и радиусы
ионов K+ и Cl-.
В ячейку пипеткой наливаем 40 мл ~0.01 N раствора HCl, титруем раствором NaOH с интервалом 0,15-0,20 мл. Измеряем χ для каждой точки, данные заносим в таблицу:
|
V(KOH), мл |
χ, мсм/см |
V(KOH), мл |
χ, мсм/см |
|
0 |
4,010 |
2,13 |
1,665 |
|
0,17 |
3,700 |
2,34 |
1,898 |
|
0,38 |
3,466 |
2,52 |
2,140 |
|
0,60 |
3,110 |
2,74 |
2,335 |
|
0,76 |
2,865 |
2,92 |
2,590 |
|
0,98 |
2,513 |
3,13 |
2,816 |
|
1,18 |
2,260 |
3,32 |
3,010 |
|
1,32 |
2,050 |
3,50 |
3,220 |
|
1,51 |
1,767 |
3,69 |
3,447 |
|
1,71 |
1,496 |
3,91 |
3,663 |
|
1,92 |
1,427 |
4,08 |
3,818 |
|
4,28 |
4,038 |
Построили график. До т. эквивалентности имели график вида: y=3,9519-272,249x, после: y=-0,63684+212,585x.
Точка излома соответствует V(KOH)=1.83 мл, N(КОН)=0.2066 N
Нашли концентрацию кислоты: a=N(HCl)=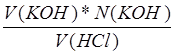 =
=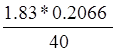 =0.00945 N
=0.00945 N
В точке эквивалентности единственный электролит – KCl с концентрацией ~0.01 М, ожидаемое значение χ0,01(KCl)=0.001411 Ом-1см-1
В точке эквивалентности: ![]() отсюда
отсюда
![]() 0.00747 см·м2·г-экв-1
0.00747 см·м2·г-экв-1
Для слабокислой области (x<a) имеем уравнение:
![]()
Для щелочной области (x>a) выражение имеет вид:
![]()
Находим отсюда ![]() см·м2·г-экв-1
см·м2·г-экв-1
![]() см·м2·г-экв-1
см·м2·г-экв-1
![]() см·м2·г-экв-1
см·м2·г-экв-1
![]() см·м2·г-экв-1
см·м2·г-экв-1
Числа переноса:
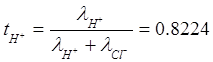
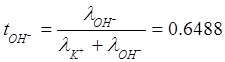
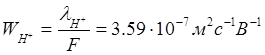
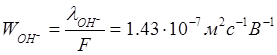
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.