Федеральное агентство по образованию
Государственное образовательное учреждение
Высшего профессионального образования
Владимирский государственный университет
Кафедра экологии
Лабораторная работа №1
На тему: «Определение pH кислотных осадков»
Выполнил студент
группы РФ – 107
Проверил
Владимир 2010
Цель работы: определить водородный показатель кислотных осадков.
Оборудование и реактивы: штатив, бюретка, мерный цилиндр, три титровальных колбы, химическая воронка, стакан, коническая колба, раствор щёлочи КОН, раствор фенолфталеин.
Выполнение работы
Используем метод «титрование», который заключается в постепенном медленном прибавлении раствора с точно известной концентрацией к раствору с неизвестной определяемой концентрацией в присутствии индикатора.
В коническую колбу отбираем 25 мл исследуемого раствора, добавляем 4–5 капель индикатора фенолфталеина. Бюретку закрепляем в штативе, вливаем раствор КОН выше нулевой отметки, выпускаем воздух из носика бюретки. Затем доводим раствор КОН до нулевой отметки, титрируем последовательно каждую колбу до перехода бесцветной окраски в слабо-розовую, сохраняющуюся в течение 15-20 секунд. Записываем значения объёма в журнал, производим расчёты.
Значение концентрации [Н+]:
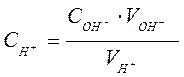 , где
, где
- С[ОН–] – концентрация КОН, (г экв/л);
- V[ОН–] – объем раствора КОН, пошедший на титрование, мл;
- V [Н+] – объем кислотных осадков взятый для определения, мл.
Вычисляем значение рН по формуле:
рН = – lg С[Н+].
Практическая часть
V1 = 8,85 мл
V2 = 8,70 мл
V3 = 9,00 мл
Vср = (8,85 + 8,70 + 9,00)/3=8,85 мл
СОН=0,004 г*экв/л
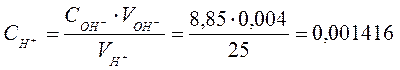 г*экв/л рН = – lg
(0,001416) = 2,85
г*экв/л рН = – lg
(0,001416) = 2,85
Вывод.
Входе проделанной работы я определил рН=2,85, который является кислотным осадком, т. к. находится на интервале кислот.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.