При температуре Т1= 1273 К система состоящая из:
в% (5 мол%) NiF2 находится в жидкой фазе (расплав состава 5 мол.%);
г% (20 мол%) NiF2 находится в жидкой фазе (расплав состава 20 мол%);
д% (40 мол%) NiF2 находится в двухфазном состоянии (расплав состава 29 мол%, кристаллы вещества NiF2·KF).
При охлаждении до температуры Т2= 1113 К получаем следующие результаты:
в% (5 мол%) NiF2 остаётся в однофазном состоянии (расплав состава 5 мол.%);
г% (20 мол%) NiF2 переходит в двухфазное состояние (расплав состава 12,9 мол. % и кристаллы вещества NiF2·4KF);
д% (40 мол%) NiF2 становится двухфазной, при этом происходит выпадение твёрдых кристаллов NiF2·KF и NiF2·3KF.
7. Определение числа фаз и числа термодинамических степеней свободы системы при эвтектических температурах
Для этой цели используется правило фаз Гиббса (для постоянного давления), которое гласит, что число степеней свободы равновесной системы, на которую из внешних факторов влияют температура и состав, равно числу независимых компонентов системы минус число фаз плюс два :
f = n + 2 – k (p = const), где n – число компонентов системы ;
k – число фаз системы.
Как только мы достигнем эвтектической температуры, расплав окажется насыщенным относительно компонента АВ4(NiF2·4KF), и тогда оба компонента, В(KF) и АВ4(NiF2·4KF), выделяются в виде механической мелкодисперсной смеси кристаллов с постоянным составом до полной кристаллизации. Этот расплав называется эвтектическим. Состав расплава не изменяется, температура тоже постоянна, и в равновесии находятся три фазы: одна жидкая и две твердые. Следовательно, в эвтектической точке имеет место нонвариантное равновесие (f = 1+ 2 – 3 = 0). На кривой охлаждения горизонтальный участок. Нонвариантное равновесие имеет место также при кристаллизации чистого компонента и при кристаллизации химического соединения постоянного состава.
8. Определение температуры начала отвердевания плава и определение состава первых выпавших кристаллов
При охлаждении расплава фигуративная точка доходит до положения линии ликвидуса, в котором расплав становиться насыщенным одним из компонентов и представляет собой одну фазу. При дальнейшем отнятии теплоты начинается кристаллизация этого компонента. Но выделение кристаллов изменяет состав остающегося расплава в сторону обогащения его другим компонентом, и кристаллы первого компонента оказываются в равновесии с жидкой фазой уже иного состава. По мере выделения первого компонента его содержание в расплаве непрерывно уменьшается, а, следовательно, температура, необходимая для дальнейшей кристаллизации, непрерывно понижается. Выделение кристаллов продолжается до тех пор, пока фигуративная точка жидкой фазы не совпадет с точкой эвтектики. При температурах более низких, чем эвтектическая точка, система состоит из двух кристаллических фаз.
Плав, содержащий 5 мол% NiF2 начнет отвердевать при 1098 К, отвердеет полностью при 1060 К, первые кристаллы будут полностью состоять из вещества KF.
9. Определение температуры плавления сплава и состава первых капель плава
Сплав, содержащий 20 мол.% вещества NiF2 начнёт плавится при температуре эвтектики 1060 К, расплавится полностью при температуре 1080 К. Первые капли плава будут содержать 9,2 мол.% вещества NiF2 и 90,8 мол.% вещества KF.
10. Определение теплот плавления данных веществ
Теплоту плавления веществ можно рассчитать с помощью уравнения Шредера:
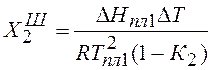 , где
, где ![]() - понижение температуры кристаллизации раствора
концентрации
- понижение температуры кристаллизации раствора
концентрации ![]() ;
;
![]() - концентрация вещества в расплаве;
- концентрация вещества в расплаве;
![]() Т1 – температура начала
кристаллизации,
Т1 – температура начала
кристаллизации,
![]() - температура плавления
растворителя;
- температура плавления
растворителя;
![]() - теплота плавления растворителя.
- теплота плавления растворителя.
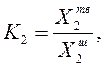
где ![]() - концентрация вещества в твердом
растворе.
- концентрация вещества в твердом
растворе.
Для неизоморфно
кристаллизующихся систем ![]() =0; а значит, и К2=0.
=0; а значит, и К2=0.
Выразив из этого уравнения DН, получим:
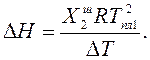
Молярные массы веществ:
M(NiF2) = 97 г/моль;
M(KF) = 58 г/моль.
Температуры плавления веществ:
Tплч(NiF2) = 1121К; Tплч(KF) = 1391 К.
Температура начала кристаллизации системы, содержащей 10% NiF2 Т1=1060К.
Температура
плавления растворителя KF ![]() =1391К.
=1391К.
Понижение температуры кристаллизации :
DТ = 1121-1060 = 61К.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.