Уравнения состояния газа. Идеальный газ, реальный газ. Формы (виды) уравнений состояния для газов. Уравнение Нобля-Абеля (Дюпре), как следствие уравнения Ван-дер-Ваальса.
Конкретная запись зависит от модели представления газа
· Идеальный газ
· Реальный газ
Идеальный – пренебрегаем объемом, занимаемым молекулами. Силами взаимодействия между молекулами тоже пренебрегаем.
Связь между давлением, плотностью и температурой описывается уравнением Клапейрона-Менделеева: pW=wRT или p= rRT (1)
где p – давление; W – объем; R=nr; n =1000/M - число молей газа в 1 кг пороха; М=23-25 г/моль; r=8,3143 КДж/(кг.град) – универсальная газовая постоянная; Т – температура газа.
Формула (1) применяется для давлений до 50 МПа.
Реальный газ - Объем, занимаемый молекулами, учитывается, как и силы взаимодействия между молекулами
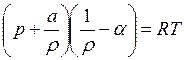 Связь между давлением, плотностью и
температурой описывается уравнениями Ван-дер-Ваальса, Нобля-Абеля (Дюпре) и
вириальным.
Связь между давлением, плотностью и
температурой описывается уравнениями Ван-дер-Ваальса, Нобля-Абеля (Дюпре) и
вириальным.
Уравнение Ван-дер-Ваальса
(2)
где a – коэффициент, учитывающий сцепление между молекулами; a – коволюм газов (дм3/кг), параметр, равный учетверенному собственному объему молекул.
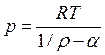 Формула (2) применяется при давлениях в
десятки тысяч МПа.
Формула (2) применяется при давлениях в
десятки тысяч МПа.
Уравнение Нобля-Абеля (Дюпре) (3)
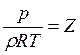 Это частный случай уравнения
Ван-дер-Ваальса, в котором параметром и пренебрегается. Формула (3) применяется
при давлениях от 50 до 2000 МПа.
Это частный случай уравнения
Ван-дер-Ваальса, в котором параметром и пренебрегается. Формула (3) применяется
при давлениях от 50 до 2000 МПа.
![]() Вириальное уравнение состояния ,
(4)
Вириальное уравнение состояния ,
(4)
где (5)
Z – сжимаемость газа, B, C, D и Е – вириальные коэффициенты, зависящие от температуры газа.
Физический смысл газовой постоянной
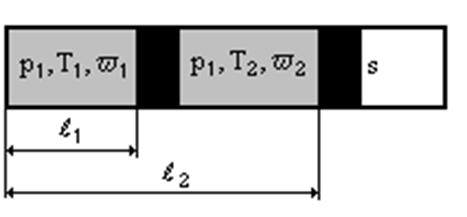
Идеальный поршень (поршень, при перемещении которого не учитываются масса и сила трения) при изменении параметров состояния имеет возможность свободно перемещаться. Для изменения начальных параметров состояния нагреем газ в цилиндре при p1=const на 1К. В результате поршень переместится из положения I в положение II. При перемещении поршня будет совершена работа A=p1s(l2-l1). Так как sl1=W1, а sl2=W2 ,то A=p1(W2-W1) , и тогда A=R(T1+1) , т.е. R=A .
Таким образом, газовая постоянная R по физическому смыслу представляет собой механическую работу, совершаемую единицей массы газа при его нагреве на 1К и расширении при p= const. ИМЕННО НА 1 К!!
![]() Для использования уравнений состояния
газов необходимо знать в каждый момент времени массу образовавшегося
газа . Ее количество зависит от скорости газообразования при горении
пороха.
Для использования уравнений состояния
газов необходимо знать в каждый момент времени массу образовавшегося
газа . Ее количество зависит от скорости газообразования при горении
пороха.
Физическая картина горения пороха. Зоны горения.
Порох – это многкомпонентная твердая система, способная гореть без доступа кислорода извне. Дымные пороха на открытом воздухе воспламеняются при температуре = 270-320 С, бездымные - при температуре около 200 C. Скорость воспламенения для дымных порохов составляет 1-3 м/с, для бездымных Порохов - 0,001-0,004 м/с.
Скорость горения дымных порохов при нормальном давлении составляет 1 мм/с, пироксилиновых - 0,07 мм/с, нитроглицериновых-0,06-0,15 мм/c. Механизм горения порохового зерна может быть описан на микро-или макро уровнях. По сложившимся представлениям горение порохов может быть описано в виде трех основных стадий:
1) физических и химических структурно-фазовых превращений вещества, происходящих в тонком поверхностном слое зерна;
2) процессов превращения вещества в области, граничащей с поверхностным слоем;
3) процессов превращения промежуточных продуктов реакции в конечные продукты в гомогенной газовой области, называемой зоной пламени.
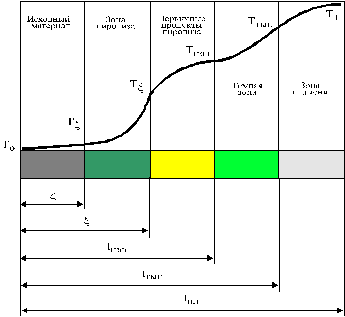
Эти стадии в совокупности образуют пять характерных зон (рис.3): прогрева, физико-химических превращений - зону пиролиза, паро-газо-дымную, окислительно-восстановительных процессов ("темную" зону) и пламени. (см.далее)
Фазы процесса горения пороха. Процесс образования окончательного состава газов.
Эти стадии в совокупности образуют пять характерных зон (рис.3): прогрева, физико-химических превращений - зону пиролиза, паро-газо-дымную, окислительно-восстановительных процессов ("темную" зону) и пламени.
![]()
![]()
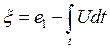
![]()
 - подвижная координата, связанная с изотермой температуры начала разложения
пороха (до достижения условия она равна половине толщины свода
горения порохового зерна e1 ; - подвижная
координата, зависящая от скорости горения и определяемая по уравнению
- подвижная координата, связанная с изотермой температуры начала разложения
пороха (до достижения условия она равна половине толщины свода
горения порохового зерна e1 ; - подвижная
координата, зависящая от скорости горения и определяемая по уравнению
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.