Несовершенство современной технологии не позволяет полностью перерабатывать минеральное сырье. Большая его часть возвращается в природу в виде отходов. Готовая продукция составляет всего лишь 1 - 2% от используемого сырья, а все остальное идет в отходы, что свидетельствует о неразумном подходе к природным ресурсам. Ежегодно в биосферу поступает более 30 млрд.т отходов: бытовых и промышленных-жидких, твердых и газообразных, загрязняющих атмосферу, гидросферу и литосферу.
4. Кислотные дожди.
Сера — это важный биофильный элемент. В животных тканях она находится в составе белков и аминокислот, а в растительных — в составе эфирных масел.
Основным природным источником серы служат вулканы, с выбросами которых в атмосферу поступают диоксид серы, сероводород и элементная сера общим количеством 4 - 16 млн.т (в пересчете на диоксид серы). Кроме того, сероводород является продуктом жизнедеятельности бактерий-хемосинтетиков, обитающих на суше и в океане. В виде сульфат-иона сера содержится в природных водах, средняя его концентрация составляет 2,65 мг SO4/1 г Н20. В составе многих минералов (уголь, нефть, железные, медные и другие руды) неорганическая сера встречается в земной коре.
В атмосфере соединения серы претерпевают целый ряд превращений (см рисунок ниже). Сероводород последовательно, в ряд ступеней, окисляется до диоксида серы, который, в свою очередь, тоже окисляется до серного ангидрида в результате фотохимического и радикального механизмов его взаимодействия с компонентами атмосферы, причем эти процессы существенно ускоряются в присутствии оксидов азота или углеводородов, а также оксидов железа, алюминия, хрома и других металлов. Атмосферная влага тоже способствует окислению диоксида в триоксид: в дождливую или туманную погоду время существования атмосферного диоксида серы не превышает 50 - 60 мин.
Атмосферный цикл соединений серы.
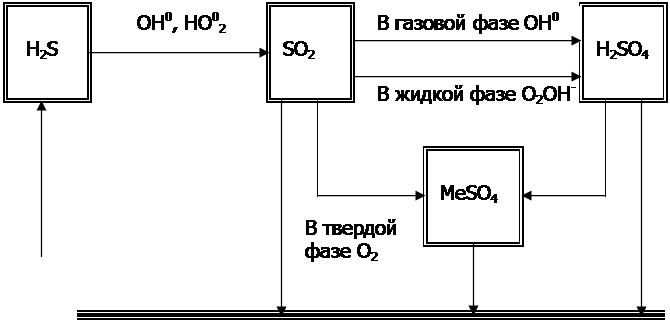 |
|||
|
|||
Триоксид серы легко взаимодействует с частицами атмосферной влаги и образует растворы серной кислоты. Реагируя с аммиаком или ионами металлов, присутствующими в атмосферной влаге, серная кислота частично переходит в соответствующие сульфаты. В основном это сульфаты аммония, натрия, кальция. Образование сульфатов происходит и в процессе окисления на поверхности твердых частиц, взвешенных в воздухе. Образовавшиеся сульфаты сохраняются в атмосфере не более 5 дней.
Значительная часть соединений серы оседает на землю с атмосферными осадками. Таким образом, из атмосферы сера снова попадает в гидросферу и в почву. Дождевая вода всегда имеет более кислую реакцию, чем поверхностные воды, ее рН составляет 5,6. В естественном цикле подобным путем обеспечивается необходимое подкисление почвы и почвенных растворов, позволяющее трансформировать минеральные питательные вещества в доступную для растений растворимую форму. Однако уже к 1976 г. 65% всех поступлений серы в атмосферу имело антропогенное происхождение, из них 95% приходилось на диоксид серы. Таким образом, поступление серы из природных источников было превышено более чем в два раза. Сернистый ангидрид в промышленности образутся при сжигании угля и нефти и при обжиге сульфидных руд меди, никеля, свинца, цинка. Соединения серы содержатся и в выбросах автотранспорта.
В первые моменты после выброса диоксида серы в атмосфере практически отсутствуют частицы серной кислоты и сульфатов. Со временем доля SO2 в воздухе уменьшается, одновременно растет доля серы в виде серной кислоты и сульфатов. Количество серной кислоты в атмосфере достигает максимума спустя 10 часов после выброса, а сульфатов — через 30 - 40 часов.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.