состояния.
Найдём параметры критического состояния: Vкр V
Vкр=3b;Pкр=a/(2+b2); Ткр=8а/27bR
Т>Tкр - идеальный газ;
T<Tкр - реальный газ.
Внутренняя энергия реального газа: U=vCvT-v2*a/V
Дросселирование - это адиабатическое вытеснение газа через узкое отверстие или пористую пробку, с последующим понижением давления.
Эффект Джоуля: при адиабатическом дросселировании газа происходит либо его охлаждение, если Т1<Ti, либо нагревание - Т1>Ti.
Ti=2a/Rb - точка инверсии.
Кристаллическое состояние вещества.
Кристаллические тела обладают ассиметричной кристаллической решёткой.
Сv=3R - закон Дюлонга-Пти (класич. Выражение для теплоемкости кристалла).
Фононы - частицы соответствующие упругим волнам в кристалле.
Фононный газ - квантовый газ, который подчиняется статистике Бозе-Эйнштейна, потому что фонон имеет спин равный нулю.
![]() - максимальная энергия фонона.
- максимальная энергия фонона.
Поверхностный слой жидкости обладает 3 свойствами:
1. Давлением молекулярным или внутренним;
2. Поверхностная энергия - дополнительная энергия которой обладают молекулы в поверхностном слое жидкости.
3. Поверхностное натяжение - сила поверхностного натяжения приходящаяся на единицу длинны контура ограничивающего поверхность s£1 (Н/м).
Фазовые равновесия и превращения (63-64).
Фазовый переход первого рода - это переход, который происходит с поглощением или выделением энергии.
![]() Фазовый переход второго рода - это переход из одной кристаллической модификации в
другую, который не связан с поглощением или выделением теплоты.
Фазовый переход второго рода - это переход из одной кристаллической модификации в
другую, который не связан с поглощением или выделением теплоты.
Уравнение Клайперона -Клаузиуса для Ж®Г: , где r - теплота испарения 1 моля жидкости; Vj - объём одного моля жидкости; Vg - объём 1 моля газа.
![]() Фазовая диаграмма - это график. Выражающий кривую
Р=Р(Т), на которой две фазы находяться в равновесии. Уравнение
Клайперона-Клаузиуса определяет характер этой кривой.
Фазовая диаграмма - это график. Выражающий кривую
Р=Р(Т), на которой две фазы находяться в равновесии. Уравнение
Клайперона-Клаузиуса определяет характер этой кривой.
Уравнение Клайперона -Клаузиуса для Ж®Г: , где l - теплота плавления 1 моля твёрдого газа.
![]() Уравнение
Клайперона -Клаузиуса для Ж®Г: ,
Уравнение
Клайперона -Клаузиуса для Ж®Г: ,
где r - теплота сублимации 1 моля твёрдого газа.
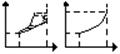 P
P
P
P
Ркр К Все 3 фазовые диаграммы сходятся
Т Ж К Ж в одной точке (тройной точке А) и
Ртр разбивают координатную плоскость
А А Т на 3 области: область твердой фазы,
Ттр Ткр Т Ттр Ткр Т жидких состояний и область газообразных состояний вещества.
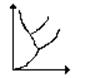 ля вещества с
несколькими Р
ля вещества с
несколькими Р
кристаллическими модификациями
диаграмма состояния имеет более сложный Т2
характер. Диаграмма для случая, когда К
число различныхкристаллических модификаций А'Ж
равно двум. Имеются 2 тройные точки А и А'. Т1
В А в равновесии находятся жидкость, A Г
газ и первая кристалл. мод-ия вещества, в А' - Т
жидкость и обе кристалл. мод-ии.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.