T2 T2
V V P
PVg=const ТVg-1=const Тg/Pg-1=const
g=Ср/Сv>1 g-1<1 Тg=Pg-1
![]() Политропическими
называются процессы, при которых теплоёмкость газа остаётся постоянной. PVn=const - уравнение
политропы.
Политропическими
называются процессы, при которых теплоёмкость газа остаётся постоянной. PVn=const - уравнение
политропы.
показатель политропы ---------------------------------Второе начало т/д.: невозможно построить периодически действующую тепловую машину, которая бы всю подводимую к ней теплоту превращала в работу, т.е. всегда n<1.
Обратимый процесс – это процесс, при котором при возвращении в исходное состояние ни в самой системе, ни в окружающих телах не остаётся никаких изменений. Если такие изменения появляются, то такой процесс называется необратимым.
Процесс, при котором система переходит из состояния 1 в состояние 2, а затем возвращается в исходное состояние 1 через другие промежуточные состояния, называется круговым или циклом.
Тепловая машина представляет собой систему совершающую многократно некоторый круговой процесс или цикл. Её кпд: h=A/Q1=(Q1-Q2)/Q1
Цикл Карно – это идеальный цикл, который даёт максимальный КПД. Состоит из двух изотерм и двух адиабат. h= (Q1-Q2)/Q1=(Т1-Т2)/Т1
 P 1 1-2
- изотермическое расширение Т2;
P 1 1-2
- изотермическое расширение Т2;
Q1 2 2-3 - адиабатическое dQ=0;
3-4 - изотермическое сжатие, Т2;
dQ=0 dQ=0 4-1 - адиабатическое dQ=0.
4 Q2
3V
 Энтропия и
второе начало термодинамики (57).
Энтропия и
второе начало термодинамики (57).
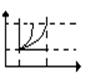
Энтропия – это такая функция состояния, T дифференциал которой определяется T2 отношением. dS=dQ/T - изменение энтропии. 1 2 3
1 - адиабатич
2 - изохорич T1 4
3 - изобарич S
4 - адиабатич
Число различных микросостояний соответствующих данному макросостоянию называется статистическим весом W или термодинамической вероятностью макросостояния. S=k*lnW - энтропия.
Энтропия обладает следующими свойствами: 1) энтропия изолированной системы при протекании необратимого процесса возрастает; 2) энтропия системы находящейся в равновесии - максимальна. Эти утверждения и составляют содержание II начала т/д: энтропия изолированной системы может только возрастать, либо по достижении максимального значения остаётся постоянной т.е. DS³0.
Реальный газ (58-59).
Реальный газ - это такой газ, частицы которого обладают собственным объёмам, а так же взаимодействуют друг с другом и поэтому обладают не только кинетической, но и потенциальной энергией.
Уравнение состояния реального газа: (P+Pi)(V+Vi)=vRT
1)
 Vi
- поправка к V, где i - ¼
часть собственного объёма молекул одного моля.
P
Vi
- поправка к V, где i - ¼
часть собственного объёма молекул одного моля.
P
2) Pi=v2a/V2 - поправка к Р.
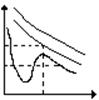
Уравнение Ван-дер-Ваальса:
Pкр K T>Tкр
V1 V2 V3 Tкр
K- точка критического равновесия
Vкр,Pкр,Ткр,- параметры критического Т<Ткр
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.