Цель работы.
Нахождение скорости фотохимической реакции с определением её квантового выхода.
Изучаемая реакция:
H2O2 + hv → H2O + (1/2) O2
a) H2O2 + hv → H2O2*
б) H2O2* → 2OH.
в) OH. + H2O2 → H2O + HO2.
г) HO2 + H2O2 → H2O + H2O4 + OH.
д) H2O4 + hv → 2OH. + O2
Ход работы.
Компоненты установки:
Измерения и расчёты.
Sсеч = 7,19 см2
I = 1.4 А
CH2O2 = 0.3
|
№ измерения |
Время от начала реакции |
Показание бюретки |
Объём газа, см3 |
Скорость реакции, см3ּмин-1 |
lg υ(τ) |
|
1 |
1 |
1 |
1 |
3,25 |
0,51 |
|
2 |
3 |
7,5 |
7,5 |
4,50 |
0,65 |
|
3 |
5 |
16,5 |
16,5 |
4,65 |
0,67 |
|
4 |
7 |
25,8 |
25,8 |
5,25 |
0,72 |
|
5 |
9 |
36,3 |
36,3 |
4,65 |
0,67 |
|
6 |
11 |
45,8 |
45,8 |
4,20 |
0,62 |
|
7 |
13 |
54 |
54 |
- |
- |
Vij = (atj – ati) / (tj – ti) где (tj – ti) = 2
V = A exp (Yt) = 6,83
Y = (0,65 – 0,44) / 3 = 0,07
lg (A) = 0,44 => A = 100,44 = 2,75
Vmax = 5,25 см3/мин = 0,00046 моль/с
Vmax = (dNмол / Na)dT => dNмол/dT = Vmax * Na = 0.0027 * 1023 с-1
E/T = (Nhυ * hυ) / t = CH2O2 * P => Nhυ / t = (CH2O2 *P) / hυ
Где P = Pуд * Sсеч = 1 Вт/см2 * 7,19 см2 = 7,19 Вт
Nhυ / t = 0,03376 * 1020 с-1
Квантовый выход:
γ = (dNмол/dt) / (Nhυ / t) = (Vmax * Na* hυ) / (CH2O2 * P)
γ = 79.97
Графики зависимости V(t) и lg(t)
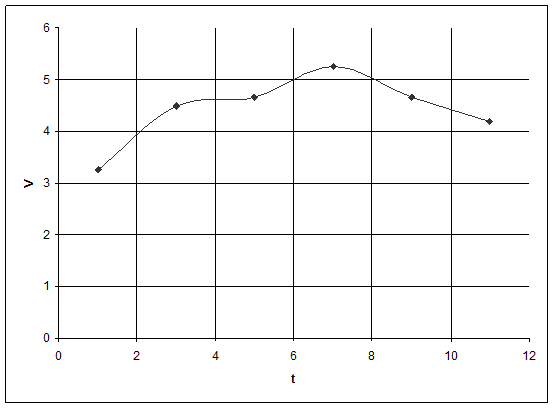
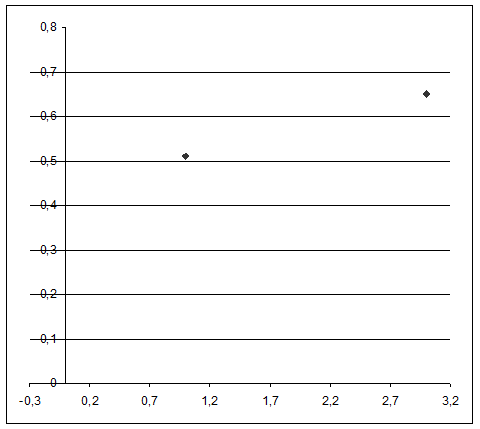
Расчёт погрешности.
γтеор. = 80
δ, % = (γтеор. – γ) / γтеор. * 100 %
δ, % = (80 – 79,97) / 80 * 100 % = 0,0375 %
Вывод.
В работе были определены скорость цепной фотохимической реакции и её квантовый выход.
Ввиду малого значения погрешности, 0,0375 %, метод можно считать пригодным для определения этих величин.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.