Нейрогуморальные модуляторы в лечении хронической сердечной недостаточности
Е.В. Шляхто НИИ кардиологии МЗ РФ, Санкт-Петербург
|
Х |
роническая сердечная недостаточность (ХСН), являясь исходом большинства сердечно-сосудистых заболеваний, представляет собой многокомпонентный синдром, включающий как гемодинами-ческие, так и нейрогуморальные сдвиги. Структурная перестройка и дилатация отделов сердца, уменьшение растяжимости миоцитов и подвижности стенок левого желудочка, задержка натрия, воды, системная вазоконст-рикция и сосудистое ремоделирование, которое повышает постнагрузку на левый желудочек, нейрогумораль-ная активация - это звенья одной цепи, представляющей известный "замкнутый крут" патогенеза ХСН. В настоящее время список нейрогуморальных факторов, способствующих неуклонному прогрессированию ХСН, достаточно велик, однако и не исчерпан полностью (табл.1).
Антагонисты рецепторов 1 -го типа к ангиотензину (ДТ) II
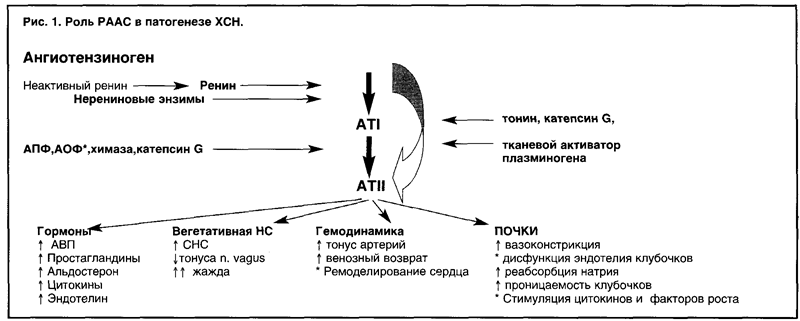
Многочисленные биологические эффекты ATII играют существенную роль в патогенезе ХСН (рис. 1) и опо-средуются через ангиотензиновые рецепторы 1, 2 и так называемых Х-типов (табл. 2). Роль РААС крови сводится к краткосрочным эффектам за счет воздействия ATII на сосудистый тонус, секрецию катехоламинов и альдосте-рона надпочечниками. Тканевые (локальные) РААС поддерживают функцию ткани при воздействии на нее ме
стных факторов. При ХСН это приводит к системному сердечно-сосудистому ремоделированию. Сравнительно новая группа препаратов АРА (антагонисты рецепторов 1 -го типа к ATII) способна блокировать рецепторы ATII 1-го типа, предотвращая основные неблагоприятные последствия активации РААС при ХСН. Одновременно возникает дополнительная стимуляция рецепторов ATII 2-го типа, что дает дополнительное антипроли-феративное действие, способствует регенерации тканей и вазодилатации.
Однако результаты плацебо-контролируемых исследований препаратов этой группы не выявили значительного преимущества АРА по сравнению с убедительно зарекомендовавшими себя ИАПФ. Обоснованные на этих результатах рекомендации по применению АРА при лечении сердечной недостаточности сформулированы в табл.3.
В ноябре 2000 г. представлены основные результаты исследования АРА вальсартана (Val-HeFT ), в которое были включены 5000 больных с проявлениями ХСН на фоне снижения систолической функции левого желудочка. Основные выводы этого протокола представлены в табл. 4.
Интерес к группе препаратов, являющихся своеобразной альтернативой для ИАПФ, у кардиологов остается, как и остается открытым вопрос о назначении АРА больным с преимущественно диастолической дисфункцией левого желудочка, а также целесообразность комбина-
|
Таблица1. Основные нейрогуморальные факторы, |
способствующие формированию и прогрессированию сердечной недостаточности |
|
|
Вазоконстрикторы |
Вазодилататоры |
Факторы роста |
|
Норадреналин Ренин-ангиотензиновая система Аргинин-вазопрессин РдЕ2, Рд12 Эндотелин Тромбоксан PgF2cc |
Натрииуретические факторы Оксид азота Допамин Кинины |
Инсулин Тумор-некротический фактор-а Гормон роста ATII Катехоламины Оксид азота Цитокины Радикалы 0^ |
|
Таблица 2. Функции АТ11 на уровне рецепторов |
|
|
Тип ангиотензиновых рецепторов |
|
|
ATI |
АТ11 и AT X |
|
Вазоконстрикция Стимуляция секреции альдостерона Высвобождение катехоламинов, аргинин-вазопрессина Гипертрофия и гиперплазия гладкомышечных клеток Синтез белка Пролиферация клеток |
Вазодилатация за счет увеличения выработки брадикинина, оксида азота, цГМФ Транспорт в почечных канальцах? Стимуляция апоптоза Торможение роста клеток Регенерация тканей Дифференцировка клеток? |
|
Таблица 3. Общие рекомендации по применению антагонистов АТ-рецепторов 1 типа при ХСН (HEART FAILURE SOSIETY GUIDLINE, 2000) |
|
1. При лечении больных со снижением систолической функции левого желудочка (как с проявлениями СН, так и без) ИАПФ имеют преимущества по сравнению с препаратами из группы АРА. 2. АРА не рекомендованы к назначению у больных с впервые возникшей СН, а также при хорошей переносимости ИАПФ. 3. Комбинированная терапия АРА и ИАПФ не должна рассматриваться в качестве рутинной, однако может быть использована для лечения больных СН при наличии высокой артериальной гипертензии или других состояний, сопровождающихся выраженной ваэоконстрик-цией. 4. Терапия АРА может быть рекомендована больным с проявлениями СН, имеющими непереносимость ИАПФ в форме ангионевротичес-кого отека и плохо переносимого кашля. |
|
Таблица 4 . Результаты исследования Val-HeFT |
|
Общие выводы: 1. Не выявлено различий в общей смертности в подгруппах больных, получавших терапию плацебо либо вальсартаном. 2. В подгруппе больных, получавших терапию вальсартаном, риск комбинированной конечной точки (смертность + заболеваемость) снижен на 13%. 3. В подгруппе больных, получавших терапию вальсартаном, риск госпитализации в связи с нарастанием СН снижен на 27%. 4. Не выявлено преимуществ в комбинации с бета-адреноблокаторами. 5. Лучшие результаты достигнуты в подгруппе больных, не получавших регулярно ИАПФ. |
|
Таблица 5. Текущие исследования влияния АРА на течение ХСН |
|||
|
Исследование (число включенных) |
Препарат |
Клинические группы, включенные в исследование |
Контроль |
|
CHARM (6500) OPTIMAAL (5000) VALIANT (14500) |
Кандесартан Лозартан Вальсартан Вальсартан + каптоприл |
а. СН/дисфункция ЛЖ на фоне ингибиторов АПФ б. СН/дисфункция ЛЖ при непереносимости ингибитора АПФ в. СН без дисфункции ЛЖ и без ингибиторов АПФ СН/дисфункция ЛЖ после инфаркта | |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.