Цель работы: изучить процесс первичной кристаллизации, рост и образование кристаллов при затвердевании.
1 ОБЩИЕ ПОЛОЖЕНИЯ
Любое вещество может находиться в четырех агрегатных состояниях: твердом, жидком, газообразном и плазменном. Переход из одного агрегатного состояния в другое называется фазовым превращением. Фазовые превращения для чистых кристаллических тел проходят при строго определенной температуре кристаллизации Мо = 26000С; Ni = 14500С; Sn= 2320С; Hg = -38,90С и т.д.
Кристаллизацией называется процесс образования кристаллов (кристаллической решетки) из жидкой или газообразной фазы (первичная кристаллизация), так и из твердой фазы (вторичная кристаллизация). Кристаллизация протекает при переходе из жидкого состояния в твердое и определяется не только тепловым, но и разнообразными физическими и физико-химическими факторами (скоростью зарождения и скоростью роста кристаллов, величиной переохлаждения, температурой перегрева, заливки и т.д.). В 1878 г. Д.К. Чернов впервые описал процесс кристаллизации стали из жидкой фазы.
Твердое состояние кристаллических тел, в том числе и металлов, характеризуется геометрически правильным расположением в них атомов «дальний порядок», а в жидкой фазе сохраняется только «ближний порядок» в расположении атомов, характеризующий правильность в расположении ближних соседей данного атома, т.е. небольшой группы атомов. При приближении к температуре кристаллизации еще в жидком состоянии атомы в отдельных микрообъемах располагаются приблизительно так же, как и в твердом состоянии.
При плавлении металлов происходит разрушение кристаллической решетки, представляющей собой совокупность закономерно расположенных атомов в металле, а при кристаллизации – образование кристаллической решетки.
Предпочтительность образования и устойчивость той или иной фазы металла при определенных внешних условиях определяется в соответствии с законами термодинамики.
Всякое фазовое превращение сопровождается уменьшением свободной энергии. Под свободной энергией (G) понимают ту часть внутренней энергии, которая может быть превращена в работу. Каждая фаза характеризуется своей зависимостью свободной энергии на еденицу объема от температуры (рис.1).
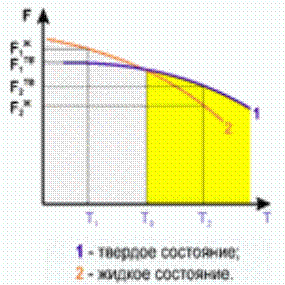

При температуре равновесной кристаллизации (Т0) кривые 1 и 2, характеризующие свободную энергию жидкой и твердой фаз, пересекаются. При той температуре ни процесс плавления, ни процесс кристаллизации до конца протекать не могут. Охлаждение системы от равновесной температуры кристаллизации (Т0) до температуры (Т1) переводит ее в состояние, когда твердая фаза будет обладать меньшей свободной энергией, чем жидкая, и будет более устойчивой. Это возможно только при некотором переохлаждении системы. Разность температур Т0 – Т1 = ∆Т представляет собой переохлаждение, которому соответствует разность свободных энергий Gж – Gт = ∆G.
Д.К. Чернов показал, что кристаллизация складывается из двух процессов:
1) скорости возникновения центров кристаллизации (Vв.ц.к);
2) скорости роста центра кристаллизации (Vр.ц.к).
Скоростью возникновения центров кристаллизации называется количество зародышей, образовавшихся в еденице объема за еденицу времени. Скоростью роста центров кристаллизации называется скорость увеличения линейных размеров растущих граней центра кристаллизации в единицу времени. При температурах близких к Т0 в жидкой фазе появляются некоторые группировки атомов очень малых размеров
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.