




























Содержание
1. Азот в железе
1.1 Адсорбция________________________________________________2
1.2 Диффузия_________________________________________________3
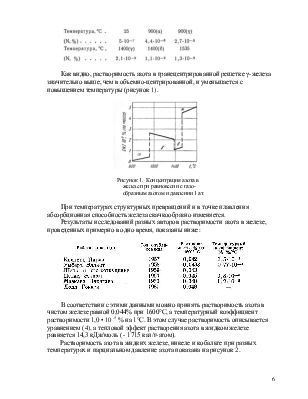
1.3 Растворимость_____________________________________________5
1.4 Химическое взаимодействие_________________________________8
2. Азот в стали
2.1 Диффузия________________________________________________13
2.2 Растворимость____________________________________________14
2.3 Химическое взаимодействие________________________________15
2.4 Влияние азота на свойства стали
2.4.1 Азот как легирующий элемент__________________________16
2.4.2 Процессы дисперсионного выделения____________________20
2.4.3 Старение____________________________________________22
2.4.4 Межкристаллитная коррозия под напряжением____________26
2.4.5 Повышение поверхностной твердости путем азотирования__________________________28
2.5 Азот в стали в процессе ее производства
2.5.1 Азот в передельных шлаках____________________________ 34
2.5.2 Изменение содержания азота в стали по ходу плавки_______34
Список литературы_____________________________________________36
1. Азот в железе
1.1 Адсорбция
Механизм поверхностной физической адсорбции азота аналогичен соответствующему для водорода. Физическая адсорбция не является специфичной для какого-либо газа. Все газы адсорбируются приблизительно в одинаковой степени, и адсорбция зависит главным образом от природы поверхности адсорбента. Механизм адсорбции обусловлен ван-дер-ваальсовыми силами взаимодействия. Процесс физической адсорбции протекает с большой скоростью и полностью обратим. С увеличением давления физическая адсорбция повышается, а с повышением температуры – уменьшается.
При активированной адсорбции или хемосорбции на переходных металлах (в частности на железе) молекулы азота диссоциируют на атомы, так как при этом обеспечивается максимальная энергия связи с атомами металла. Неспаренные электроны отдельных атомов газа, образовавшихся при диссоциации, связываются с электронами d-зоны, заполняя в ней дырки. По мере заполнения дырок в d-зоне уменьшается парамагнитная восприимчивость металла. Это позволяет изучать процессы хемосорбции по изменению парамагнитной восприимчивости.
Связь хемосорбированных атомов азота с поверхностью железа чисто ковалентная (у водорода – преимущественно ковалентная, с долей ионной связи примерно 7 – 8 %).
В отличие от водорода, диссоциирующего при хемосорбции на всех переходных металлах с частично заполненными d-зонами, азот в виде атомов легко адсорбируется только на тех металлах, которые имеют в d-оболочке изолированного атома три и более вакантных места (W, Та, Mo, Ti, Zr и др.). По-видимому, это связано с существованием тройной связи в молекуле азота.
Хемосорбция так же зависит от состояния поверхности металла. Неоднородная поверхность обладает различной адсорбционной активностью участков. Даже чистая поверхность металла неоднородна, так как атомы в дислокациях, на ребрах или в вершинах кристаллов, по-видимому, более адсорбционно активны, чем атомы, лежащие в плоскости грани кристалла.
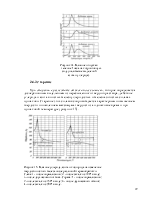
В отличие от водорода азот мгновенно адсорбируется на поверхности сублимированных пленок железа при низких температурах (от 78° К). Теплота адсорбции невелика и уменьшается по мере заполнения поверхности адсорбированным газом от 21,78 до 12,97 КДж/моль (от 5,2 до 3,1 Ккал/моль) или, по другим источникам, от 41,9 до 20,9 КДж/моль (от 10 до 5 Ккал/моль).
Незначительная теплота адсорбции и способность водорода вытеснять при этих температурах предварительно адсорбированный на поверхности азот свидетельствуют о незначительных силах химической связи частиц азота с поверхностью железа.
По-видимому, существует два типа адсорбции азота на поверхности железа — молекулярная при низких температурах и медленная (активированная) атомарная, наблюдаемая выше 0° С.
Принято считать, что низкотемпературная хемосорбция азота на железе носит молекулярный характер. Химическая связь атомов в молекуле азота не разрушается, а только ослабевает, т. е. тройная связь заменяется одинарной или двойной связью; свободные валентные электроны молекулы взаимодействуют с двумя атомами железа на поверхности. Механизм этого взаимодействия представляется следующим образом:
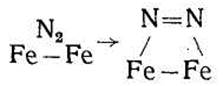
Или
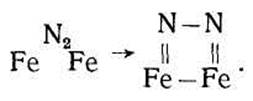
С дальнейшим повышением температуры (до комнатной и выше) силы химического взаимодействия между поверхностью железа и азотом возрастают, что подтверждают опыты.
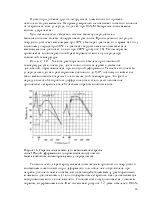
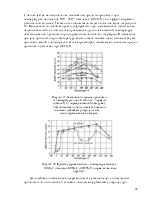
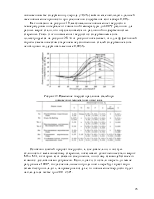
Атомарный характер активированной адсорбции подтверждается образованием аммонийных солей при обработке кислотами поверхности железа, насыщенной азотом. Теплота активированной адсорбции велика и при комнатной температуре уменьшается со 167 до 67 КДж/моль (с 40 до 16 ККал/моль). Остальная часть поверхности при комнатной температуре атомами азота не покрывается, что объясняется большой энергией активации. Можно предполагать, что азотом покрываются только наиболее активные ее участки, и атомы азота с этих участков мигрировать не могут.
Скорость адсорбции возрастает с повышением температуры. Значительно медленнее при этом увеличивается скорость десорбции.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.