Удельный мольный объем – объем, занимаемый одним молем вещества.
Число Авогадро (постоянная Авогадро) – число структурных единиц (молекул) в одном моле; равно 6,024*1023 моль1.
9.2 Изменение величин при изменении размерностей
Пусть рассматривается некоторая величина G.
Пусть значение этой величины при использовании первой группы размерностей G1 = G1D×[G1] (здесь G1D – численное значение величины G1). При использовании второй группы размерностей, соответственно G2=G2D×[G2].
Если размерности связаны соотношением [G1] = kr×[G2] (например, [м] = 10-3 [км], kr = 10-3), то при переходе от первой размерности (или группы размерностей) [G1] ко второй [G2] величина G изменится от G1 = G1D×[G1] на G2 = G1D×kr×[G2]. Т.е. G2D = G1D×kr.
Тогда отношение численных значений величины G, записанной через вторые и первые размерности, будет
G2D/G1D = G1D×kr/G1D = kr, соответственно.
Величина G может быть как простой величиной (единичная размерность длина, время, масса и т.д.), так и сложной (расход, плотность и т.д.).
Коэффициенты, связывающие
сложные размерности, можно выразить через коэффициенты, связывающие простые размерности.
Например, пусть [g1i] – первая система простых
размерностей, [g2i] – вторая система соответствующих
размерностей (соответствие: [м] и [мм], [ч] и [сек] и т.п.). При этом [g1i] = ki [g2i]. Тогда 
Таким образом, отношение численных значений величины, в разных размерностях
G2D/G1D=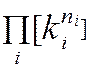 ,
,
где ki определяется из соотношения [g1i] = ki [g2i], а [g1i] – первая система простых размерностей, [g2i] – вторая система соответствующих размерностей (соответствие: [м] и [мм], [ч] и [сек] и т.п.; это могут быть и комплексы, например, [м3] и [л], [м/с] и [км/ч] и т.д.)
Примеры:
Во сколько раз изменится численное значение
· скорости при переходе от [м/с] к [км/ч]?
[м] = 10-3 [км], [с] = 3600-1 [ч]
G2D/G1D=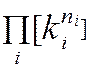 =10-3/3600-1=3,6
=10-3/3600-1=3,6
· расхода при переходе от
(а) [кг/ч] к [л/с]: [кг] = r-1[л] (r - плотность, [кг/л]), [ч] = 3600 [с].
G2D/G1D=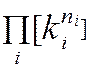 = r-1/3600
= r-1/3600
(б) [кг/ч] к [моль/ч]: [кг] = М-1[моль],
G2D/G1D=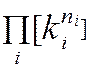 = 1/М (М - молярная
масса)
= 1/М (М - молярная
масса)
(в) [кг/ч] к [л/мин], [м3/с]: [кг] = r-1[л] (r - плотность, [кг/л]), [ч] = 60 [мин],
G2D/G1D=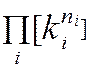 = r-1/60
= r-1/60
9.3 Вопросы и задачи
Уравнения реакции, порядок реакции, кинетические зависимости
1. Установить связь между расходами веществ в одной и той же реакции: рассмотреть несколько единственных реакций, записать расходование веществ, если известен расход (в реакции) одного вещества.
2. В смеси из четырех газов при давлении Р0 протекают следующие реакции:
1) 2А1®A2,
2) A3+A4+A5®A6.
В начальный момент времени
скорость первой реакции в три раза больше, чем скорость второй реакции, а
соотношение начальных концентраций ![]() ,
, ![]() . Определить отношение констант скорости k1/k2.
. Определить отношение констант скорости k1/k2.
3.
Напишите
кинетическое уравнение для реакции 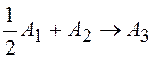 .
.
4. Написать уравнение для скорости образования и расходования всех реагентов для процесса
 ,
,
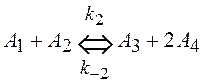 .
.
Каков порядок реакций по реагентам? Указать размерность констант скоростей всех процессов.
5. Написать уравнения для скорости образования и расходования всех реагентов для процесса
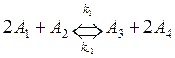 ,
,
![]() .
.
Каков порядок реакций по реагентам? Указать размерность констант скоростей всех процессов.
6. Написать систему кинетических уравнений для последовательных реакций
 ,
,
 ,
,
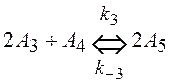 .
.
7.
Записать
выражения для ![]() ,
, 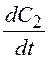 и
и ![]() , если реакция описывается схемой (Ci- концентрация, t – время)
, если реакция описывается схемой (Ci- концентрация, t – время)
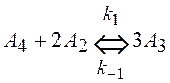 ,
,
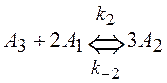 ,
,
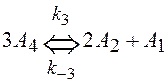 .
.
8. Превращение вещества А1 в вещество A2 протекает по двум параллельным реакциям:
1) по обратимой реакции первого порядка
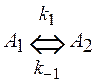 ,
,
2) по обратимой реакции второго порядка с участием иона водорода
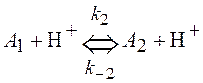 .
.
Найти константу k1, если известны константы k-1, k2, k-2.
Изменение размерностей
9. Почему в газах иногда концентрацию измеряют в единицах парциального давления?
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.