











Практические занятия по курсу
«Химическая термодинамика»
В аудитории студенты решают задачи, подобные представленным ниже.
Домашнее задание: Используя решения, представленные ниже, сформулировать собственные подобные задачи и представить их решения. Каждому студенту необходимо представить не менее одного аналога каждой задачи. Совпадения предлагаемых вариантов у разных студентов не допустимы. По возможности задачи должны доводиться до численных ответов. Там, где задача решается в общем виде, необходимо использовать другие координаты или предложить более конкретную задачу (перейти к идеальному газу, выбрать конкретное вещество и найти в справочнике необходимые данные и т.д.).
Задача 1
Показать,
что бесконечно малое приращение 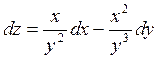 - полный
дифференциал.
- полный
дифференциал.
Это
так, если (см. стр. 10, ур. (1.11)) 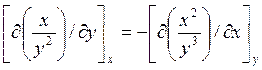
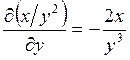 ;
; 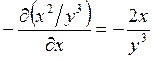 ; ─ что
и требовалось доказать.
; ─ что
и требовалось доказать.
Задача 2
Определить
теплотворную способность метана (CH![]() ).
).
Теплотворная способность – это количество тепла, выделяющееся при сжигании одного моля вещества. В данном случае необходимо рассмотреть реакцию CH4+2O2=CO2+2H2O
Теплота
реакции на один моль первого вещества ![]() (см.
(2.29) на с.16).
(см.
(2.29) на с.16).
Стандартные
теплоты образования ![]() кДж/моль,
кДж/моль, ![]() кДж/моль,
кДж/моль,
![]() кДж/моль,
кДж/моль,
![]() т.к. кислород – простое вещество. Следовательно,
т.к. кислород – простое вещество. Следовательно,
![]() кДж/моль.
кДж/моль.
Задача 3
Определить необходимое количество воздуха для сжигания 1 л метана (до углекислого газа и воды).
Число молей веществ, участвующих в реакции, пропорционально стехиометрическим коэффициентам уравнения реакции. Т.к., в соответствии с уравнением состояния идеального газа, один моль любого газообразного вещества при заданных температуре и давлении занимает один и тот же объем, то объемы реагирующих веществ также пропорциональны стехиометрическим коэффициентам.
Следовательно, в соответствии с реакцией горения метана
![]() , для одного литра
, для одного литра ![]() необходимо
2 литра
необходимо
2 литра ![]() .Содержание
.Содержание ![]() в
воздухе 20%, т.е. воздуха необходимо в 5 раз больше чем кислорода. Требуется
10 литров воздуха.
в
воздухе 20%, т.е. воздуха необходимо в 5 раз больше чем кислорода. Требуется
10 литров воздуха.
Задача 4
Определить выделившееся тепло при реакции 1 моля кислорода и 1 моля водорода и состав продуктов, если теплота образования воды – 241,6 кДж/моль
Уравнение реакции: 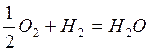 . Количество выделившегося тепла (см.
(2.24) на с.15) в данном процессе
. Количество выделившегося тепла (см.
(2.24) на с.15) в данном процессе![]() или
или ![]() . Процесс закончится, как только хотя бы
одно из веществ израсходуется. Поэтому координату реакции в момент прекращения
горения необходимо находить, как минимальное значение, из соответствующих полному
расходованию веществ, участвующих в реакции:
. Процесс закончится, как только хотя бы
одно из веществ израсходуется. Поэтому координату реакции в момент прекращения
горения необходимо находить, как минимальное значение, из соответствующих полному
расходованию веществ, участвующих в реакции: 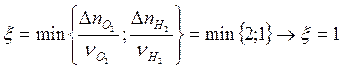 (полностью
израсходуется только водород).
(полностью
израсходуется только водород).
Следовательно,
![]() кДж/моль.
кДж/моль.
Т.к. ni=noi +nix (см. (2.22) на с. 15), то состав газа будет таким: O2 -0.5 моль, H2 -0 моль, H2O – 1 моль (учтено, что для реагентов ni<0, а для продуктов >0).
Задача 5
Определить
теплотворную способность этана (![]() ).
).
Теплотворная способность – это количество тепла, выделяющееся при сгорании 1 моля вещества.
В
данном случае уравнение реакции 2![]() ,
, ![]() ;
;
Стандартные
теплоты образования ![]() кДж/моль,
кДж/моль, ![]() кДж/моль,
кДж/моль,
![]() кДж/моль.
Следовательно,
кДж/моль.
Следовательно,
![]() кДж/моль.
кДж/моль.
Задача 6
Определить
теплотворную способность ![]() природного газа (
природного газа (![]() ), если известно, что теплотворная
способность метана
), если известно, что теплотворная
способность метана ![]() кДж/моль,
этана
кДж/моль,
этана ![]() кДж/моль.
кДж/моль.
Теплотворная способность природного газа – это количество тепла, выделяющееся при сгорании одного моля природного газа, следовательно,
![]() , где xi
– мольная доля i-го горючего компонента.
, где xi
– мольная доля i-го горючего компонента.
![]()
![]() кДж/моль.
кДж/моль.
Задача 7
Определить
состав продуктов сгорания природного газа ![]() ,
получаемых при его полном сгорании с коэффициентом избытка воздуха
,
получаемых при его полном сгорании с коэффициентом избытка воздуха ![]() 1,2. (Состав воздуха
1,2. (Состав воздуха ![]() ). Определить разность энтальпий исходных
реагентов и продуктов сгорания
). Определить разность энтальпий исходных
реагентов и продуктов сгорания ![]() (в общем виде). Нижние индексы
соответствуют температуре.
(в общем виде). Нижние индексы
соответствуют температуре.
Пусть сгорает 1 моль природного газа.
![]() ;
; 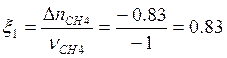 моль
моль
![]() ;
; 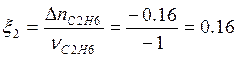 моль
моль
При
протекании нескольких реакций изменение числа молей вещества будет равно сумме
изменений по каждой j-й реакции, т.е. ![]() . Следовательно,
. Следовательно,
![]()
![]() моль.
моль.
![]() моль.
моль.
![]() моль.
моль.
Число молей исходного кислорода
![]() моль
моль
Число молей воздуха: 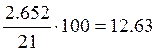 моль;
моль;
Число
молей азота в воздухе: ![]() моль;
моль; ![]()
Баланс вещества по каждому компоненту: ![]() , откуда
, откуда
![]() ;
;
![]() ;
;
Общее число молей продуктов:
![]()
Мольные доли для продуктов ![]()
(1)![]() (здесь пр – продукты сгорания, исх – исходная горючая
смесь);
(здесь пр – продукты сгорания, исх – исходная горючая
смесь);
(2)
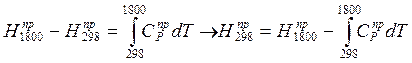 (3);
(3);
Где DH298j – теплота j-й реакции при температуре 298К. Складывая (1) и (2), получим
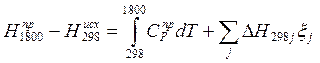
![]()
Задача 8
Получить соотношение Максвелла, используя в качестве переменных (p,T).
В этом случае характеристическая функция – энергия Гиббса (см. п. 3.2 и с.24)
![]() ;
; ![]() ;
;
Из первого закона т/д ![]()
![]() , так как G– функция состояния, то
, так как G– функция состояния, то
dG – полный диференциал.
Промежуточный зачет на 6-й неделе
Задача 9
Для
стандартных условий (25![]() С) определить, что для идеального
газа в координатах T-V наклон изобары < или > наклона адиабаты.
С) определить, что для идеального
газа в координатах T-V наклон изобары < или > наклона адиабаты.
Наклон
кривой в заданной точке определяется производной к этой кривой в данной точке.
Т.е. нам необходимо сравнить производные 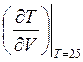 для изобарического и адиабатического процесса.
для изобарического и адиабатического процесса.
Учтем, что для идеального газа всегда выполняется уравнение состояния PV=RT.
Соответственно для 25 оС P![]() V
V![]() =RT
=RT![]() (здесь
индекс 25 означает, что все рассматривается при температуре 25 оС)
(здесь
индекс 25 означает, что все рассматривается при температуре 25 оС)
Изобарa: Из уравнения состояния 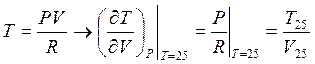 >0
>0![]()
Адиабата: Кроме уравнения состояния для адиабатического процесса
выполняется условие ![]() . Соответственно,
. Соответственно,
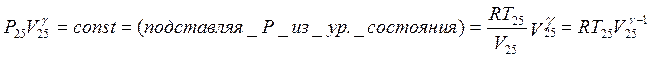
![]() .
.
Подставляя
далее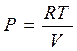
![]()
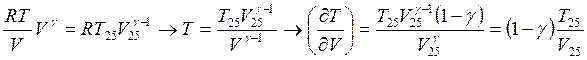
![]() <0, следовательно наклон адиабаты отрицательный
<0, следовательно наклон адиабаты отрицательный
Задача 10
Показать зависимость энтальпии, энтропии и энергии Гиббса для воды в зависимости от температуры T=0-110°C. Вода изменяет фазовое состояние от льда до пара:
|
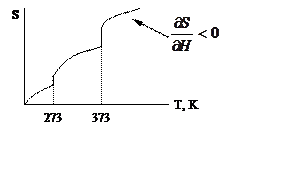 |
![]()
|
|

|
|
|
![]() à
à
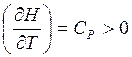 -H – возрастает;
-H – возрастает;  - H –вогнутая крив.
- H –вогнутая крив.
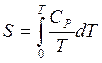 à
à 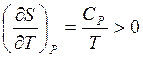 - S –
возрастает;
- S –
возрастает;  - S – выпуклая
крив.
- S – выпуклая
крив.
|
|
![]()
![]()

 |
Задача 11
Используя свойства якобиана (3.38) и (3.36) показать, что
![]() , где
, где
![]() ,
, ![]() .
.
Действительно,

Задача 12
Показать, что
![]()
Указание: использовать выражения для характеристических функций и уравнения Максвелла:
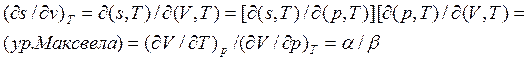
Задача 13
Показать,
что ![]() . (1)
. (1)
В
соответствии с (2.7) и (2.14) ![]() (2)
(2)
Найдем
связь между ![]() и
и ![]() : (3)
: (3)
![]() - дифференциал функции переменных V
и T. (4)
- дифференциал функции переменных V
и T. (4)
![]() - см. определение энтальпии (2.8) (5)
- см. определение энтальпии (2.8) (5)
Разделим левые и правые части уравнений (4), (5) на dTпри постоянном pи приравняем правые части
![]() . (6)
. (6)
Откуда, учитывая (2)
![]() , или
, или
![]() . (7)
. (7)
Т.к.
в соответствии с (3.14) ![]() , то
, то
![]() . (8)
. (8)
Подставляя (8) в (7), получаем
![]()
![]()
Т.к.
из задачи 12 ![]() и, учитывая, что по определению
и, учитывая, что по определению ![]() , и, следовательно
, и, следовательно ![]() ,
то
,
то
![]()
![]() =
= ![]()
Задача 14
Рассчитать
изменение энтальпии и энтропии вещества при переходе без фазовых превращений от
Т=1250К и Р=0.1 МПа к Т=1600К и Р=10 МПа, если известны удельный объём при
нормальных условиях (p= 0.1 МПа,
T=298K) ![]() = 9,4 см3/моль, коэффициенты термического
и объёмного расширения
= 9,4 см3/моль, коэффициенты термического
и объёмного расширения
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.