Билет №13
1. I-ый закон термодинамики. Тепловой эффект реакции в изобарном и изохорном процессах.
I-ый закон термодинамики: тепло, подведенное к системе идет на совершение системой работы и изменение внутренней энергии.
Q = ΔE + A -запись закона сохранения энергии
Изобарный процесс (Р - const)
Qр = ΔE + A = ΔE + pΔV
(E2 – E1) – (V1 – V2) = (E2 + pV2) – (E1 + pV1) = Н2 – Н1 = ΔH
Q = ΔH
H – энтальпия (теплосодержание системы)
Q = H > 0 Тепловой эффект реакции положителен –
Тепло поглощается – эндотермический процесс
Q = H < 0 Тепловой эффект реакции отрицателен –
Тепло выделяется – экзотермический процесс
Изохорный процесс
Qv = ΔE + A = ΔE + pΔV = ΔE (ΔV = 0, ΔVp = 0)
Q = ΔE
ΔE – внутренний эффект реакции, протекающей при постоянном V.
Тепловой эффект реакции, протекающей при постоянном давлении, больше теплового эффекта реакции при постоянном объеме на величину работы расширения pΔV.
2. Термодинамическая устойчивость систем с открытой и замкнутой цепью сопряжения. Приведите примеры.
Сопряженные системы – молекулы с чередующимися двойными и простыми связями.
Сопряжение – это перераспределение электронной плотности в системе π-связей, приводящее к стабилизации молекулы.
Энергия сопряжения – это уменьшение энергии молекулы вследствие сопряжения
Системы с замкнутой цепью сопряжения за счет круговой делокализации π-электронов обладают более высокой термодинамической устойчивостью, чем сопряженные системы с открытой цепью. Такие системы называются ароматическими.
Соединение обладает ароматичностью, если оно имеет плоский замкнутый цикл и единую сопряженную π-электронную систему, охватыващую все атомы цикла и содержащую 4n + 2 электронов (Правило Хюккеля), где n – простое целое число.
Сопряжение может быть π,π-сопряжением и р,π-сопряжением:
π,π-сопряжение – сопряжение, в которое вступили только орбитали π-связей, к системам с таким видом сопряжения относятся алифатические цепи, содержащие двойные связи, α,β-карбонильные соединения и арены, и их производные, шестичленные гетероциклические соединения с одним или двумя гетероатомами (пиридин, пиримидин)
р,π-сопряжение – сопряжение в которое вступили орбитали π-связей и р-орбиталь гетероатома, к ним относятся алифатические соединения, содержащие фрагмент ─СН=СН─Х, пятичленные гетероциклические соединения (пиррол, тиофен, фуран, имидазол…).
Приведем примеры:
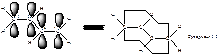
Энергия сопряжения невелика и составляет около 15 кДж/моль.
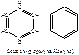
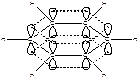
Энергия сопряжения сосавляет около 150кДж/моль.
3. Изобразите строение и наиболее устойчивую конформацию с предпочтительным расположением заместителей 2-амино-3-этоксигексанкарбоновой кислоты.
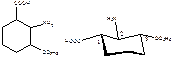
Объемные заместители располагаются в наиболее удаленых положениях друг относительно друга – т.е. в экваториальных положениях. Это наиболее энергетически выгодная конформация.
Сам цикл принимает положение «кресла», что также является наболее выгодным положением за счет отсутсвия углового и торсионного напряжения.
4. Охарактеризовать влияние заместителей, входящих в цикл 2,4-диамино-5-нитро-6-этилпиримидина. Обозначить вид и знак электронных эффектов, показать их графически.
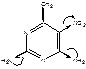
Аминогруппы обладают отрицательным индуктивным эффектом и положительнам мезомерным: + M > - I, поэтома аминогруппа является Э.Д. Повышает электронную плотность на кольце.
NO2 – группа обладает отрицательным мезомерным и индуктивным эффектами: -I, -M – сильный Э.А., понижающий электронную плотность на кольце.
СН3 – группа обладает только положительным индуктивным эффектом – Э.Д.
5. Докажите ароматичность пиррола, проведите для него реакцию метилирования. Назовите механизм реакции. Сравните реакционную способность пиррола и пиридина в этой реакции.
![]()
1. N 1s22s2p3 – в состоянии sp2-гибридизации. В образование единого π-электронного облака включется неподелнная ē пара азота. – плоский пятичленный цикл.
2. π,р-сопряжение
3. 4·1 + 2 = 6 6 = 6 Выполняется правило Хюккеля.
Пиррол - π-избыточная система (т.к. на 5 атомов приходится 6 ē).
Следственно проявляет большую реакционную способность, нежели бензол, в реакциях электрофильного замещения.

Пиридин - π-недостаточная система, поэтому в реакции электрофильного замещения вступает с большим трудом и заместители направляются в β-положения, а не α-положения, куда присоединяются заместители пиррола.
Билет №13
1. I-ый закон термодинамики. Тепловой эффект реакции в изобарном и изохорном процессах.
I-ый закон термодинамики: тепло, подведенное к системе идет на совершение системой работы и изменение внутренней энергии.
Q = ΔE + A -запись закона сохранения энергии
Изобарный процесс (Р - const)
Qр = ΔE + A = ΔE + pΔV
(E2 – E1) – (V1 – V2) = (E2 + pV2) – (E1 + pV1) = Н2 – Н1 = ΔH
Q = ΔH
H – энтальпия (теплосодержание системы)
Q = H > 0 Тепловой эффект реакции положителен –
Тепло поглощается – эндотермический процесс
Q = H < 0 Тепловой эффект реакции отрицателен –
Тепло выделяется – экзотермический процесс
Изохорный процесс
Qv = ΔE + A = ΔE + pΔV = ΔE (ΔV = 0, ΔVp = 0)
Q = ΔE
ΔE – внутренний эффект реакции, протекающей при постоянном V.
Тепловой эффект реакции, протекающей при постоянном давлении, больше теплового эффекта реакции при постоянном объеме на величину работы расширения pΔV.
2. Термодинамическая устойчивость систем с открытой и замкнутой цепью сопряжения. Приведите примеры.
Сопряженные системы – молекулы с чередующимися двойными и простыми связями.
Сопряжение – это перераспределение электронной плотности в системе π-связей, приводящее к стабилизации молекулы.
Энергия сопряжения – это уменьшение энергии молекулы вследствие сопряжения
Системы с замкнутой цепью сопряжения за счет круговой делокализации π-электронов обладают более высокой термодинамической устойчивостью, чем сопряженные системы с открытой цепью. Такие системы называются ароматическими.
Соединение обладает ароматичностью, если оно имеет плоский замкнутый цикл и единую сопряженную π-электронную систему, охватыващую все атомы цикла и содержащую 4n + 2 электронов (Правило Хюккеля), где n – простое целое число.
Сопряжение может быть π,π-сопряжением и р,π-сопряжением:
π,π-сопряжение – сопряжение, в которое вступили только орбитали π-связей, к системам с таким видом сопряжения относятся алифатические цепи, содержащие двойные связи, α,β-карбонильные соединения и арены, и их производные, шестичленные гетероциклические соединения с одним или двумя гетероатомами (пиридин, пиримидин)
р,π-сопряжение – сопряжение в которое вступили орбитали π-связей и р-орбиталь гетероатома, к ним относятся алифатические соединения, содержащие фрагмент ─СН=СН─Х, пятичленные гетероциклические соединения (пиррол, тиофен, фуран, имидазол…).
Приведем примеры:
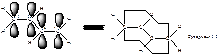
Энергия сопряжения невелика и составляет около 15 кДж/моль.
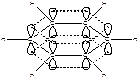
Энергия сопряжения сосавляет около 150кДж/моль.
3. Изобразите строение и наиболее устойчивую конформацию с предпочтительным расположением заместителей 2-амино-3-этоксигексанкарбоновой кислоты.
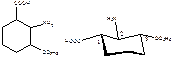
Объемные заместители располагаются в наиболее удаленых положениях друг относительно друга – т.е. в экваториальных положениях. Это наиболее энергетически выгодная конформация.
Сам цикл принимает положение «кресла», что также является наболее выгодным положением за счет отсутсвия углового и торсионного напряжения.
4. Охарактеризовать влияние заместителей, входящих в цикл 2,4-диамино-5-нитро-6-этилпиримидина. Обозначить вид и знак электронных эффектов, показать их графически.
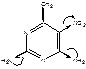
Аминогруппы обладают отрицательным индуктивным эффектом и положительнам мезомерным: + M > - I, поэтома аминогруппа является Э.Д. Повышает электронную плотность на кольце.
NO2 – группа обладает отрицательным мезомерным и индуктивным эффектами: -I, -M – сильный Э.А., понижающий электронную плотность на кольце.
СН3 – группа обладает только положительным индуктивным эффектом – Э.Д.
5. Докажите ароматичность пиррола, проведите для него реакцию метилирования. Назовите механизм реакции. Сравните реакционную способность пиррола и пиридина в этой реакции.
![]()
1. N 1s22s2p3 – в состоянии sp2-гибридизации. В образование единого π-электронного облака включется неподелнная ē пара азота. – плоский пятичленный цикл.
2. π,р-сопряжение
3. 4·1 + 2 = 6 6 = 6 Выполняется правило Хюккеля.
Пиррол - π-избыточная система (т.к. на 5 атомов приходится 6 ē).
Следственно проявляет большую реакционную способность, нежели бензол, в реакциях электрофильного замещения.

Пиридин - π-недостаточная система, поэтому в реакции электрофильного замещения вступает с большим трудом и заместители направляются в β-положения, а не α-положения, куда присоединяются заместители пиррола.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.