






Министерство образования и науки РФ
Федеральное агентство по образованию
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
новосибирский государственый технический университет
______________________________________________________________________________
Кафедра инженерных проблем экологии
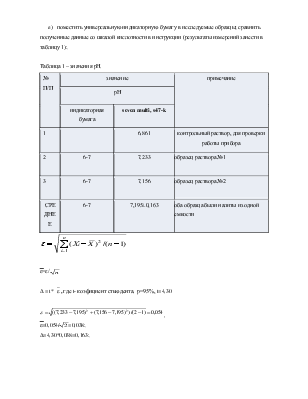
Отчет к лабораторной работе №2
«Полуколичественное и количественное определение значения
водородного показателя атмосферных осадков»
Выполнил: Проверила:
студент ФЛА, группы СЭ-71 Доцент каф. ИПЭ
Красиков В.
Ларичкина Н.И
«__________» ___________
оценка роспись
«______» _______ 2009 г.
Новосибирск
2009
I. Цель работы:
1. Ознакомиться с работой электроизмерительных приборов.
2. Научиться определять рН, электропроводность и концентрацию различных ионов водных растворов.
II. Теоретическая часть:
Водородный показатель или рН – это отрицательный логарифм концентрации ионов водорода:
Водородный показатель характеризует кислотные свойства растворов.
• впервые понятие о водородном показателе было введено в 1909 г. датским ученым С.П. Зеренсеном.
![]() Состояние динамического равновесия электролитической диссоциации воды
можно представить уравнением:
Состояние динамического равновесия электролитической диссоциации воды
можно представить уравнением:
![]() Учитывая, что ионы водорода образуют комплексные ионы Н+ и Н2О
или Н3О+, которые называются ионами гидроксония,
уравнение электролитической диссоциации воды лучше представлять в следующем
виде:
Учитывая, что ионы водорода образуют комплексные ионы Н+ и Н2О
или Н3О+, которые называются ионами гидроксония,
уравнение электролитической диссоциации воды лучше представлять в следующем
виде:
![]() Из уравнения электролитической диссоциации воды видно, концентрация ионов
водорода равна концентрации ионов гидроксила, по этому можно
сказать, что для молекулы воды справедливо равенство:
Из уравнения электролитической диссоциации воды видно, концентрация ионов
водорода равна концентрации ионов гидроксила, по этому можно
сказать, что для молекулы воды справедливо равенство:
Произведение концентрации ионов водорода и гидроксил ионов называют ионным произведением воды, и обозначают K(Н2О) или Kw.
![]() Опытным путем установлено, что при T=20-25ос значение Kw = 10-14.
Опытным путем установлено, что при T=20-25ос значение Kw = 10-14.
Ионное произведение воды остается постоянным в различных водных растворах.
При повышении температуры его значение увеличивается.
• т.к. Kw, при данной температуре неизменно, а величины являются переменными, то по этим значениям, можно судить о кислотности или щелочности водного раствора электролита. Известно, что в нейтральном растворе:
![]()
![]() Учитывая, что при комнатной температуре: Kw=10-14, получаем:
Учитывая, что при комнатной температуре: Kw=10-14, получаем:
![]() Таким образом, в нейтральной среде, концентрация ионов водорода и
гидроксил ионов равны 10-7 М. Раствор называется нейтральным, если в нем при
комнатной температуре:
Таким образом, в нейтральной среде, концентрация ионов водорода и
гидроксил ионов равны 10-7 М. Раствор называется нейтральным, если в нем при
комнатной температуре:
Увеличение или уменьшение отражается на характере среды.
![]() Для кислых растворов справедливо условие:
Для кислых растворов справедливо условие:
![]() Для щелочных растворов справедливо условие:
Для щелочных растворов справедливо условие:
Приведенный способ выражения кислотности или щелочности очень показателен, однако, он не удобен, при выражении малых концентраций ионов водорода.
На практике для характеристики кислотности (щелочности) раствора, применяют показатель водородных ионов (рН).
Для чистой воды: рН = -lg[H+] = -lg10-7 = 7
Соответственно рОН = -lg[ОH-] = -lg10-7 = 7.
При уменьшении [H+] значение рН увеличивается.
При увеличении [ОH-] значение рОН уменьшается.
В нейтральном растворе: рН=рОН=7
В кислом растворе: рН<рОН рН < 7
В щелочном растворе: рН>рОН рН>7
Т.о. рН + рОН = 14
Выражение кислотности или щелочности раствора, через водородный или гидроксильный показатель, позволяет установить состояние среды в данном растворе, и служит количественной мерой выражения его кислотности или щелочности. Если рН<7, то раствор кислый, и чем меньше рН, тем выше кислотность раствора, а чем меньше рОН, тем выше щелочность раствора.
Наглядно, представление о состоянии среды, в зависимости от величины рН, находит свое отражение на шкале «рН»:
ШКАЛА «рН»
Среда среда среда
Кислая нейтральная щелочная
[H+]>10-7M [H+]=[OH-]=10-7M [OH-]< 10-7M
0 7
14![]()
![]()
![]()
![]()
![]() увеличение кислотности
увеличение кислотности
![]() увеличение щелочности
увеличение щелочности
III. Практическая часть:
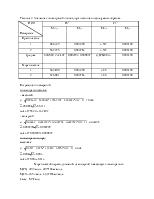
1. Характеристика объекта исследования и измеряемые параметры:
объектом исследования в данной работе являются два образца раствора.
2. Приборы (или оборудование), используемые в работе:
а) комбинированный анализатор Seven Multi, «S47-k»; б) универсальная индикаторная бумага; в) рН-метр - иономер «экотест-120»;
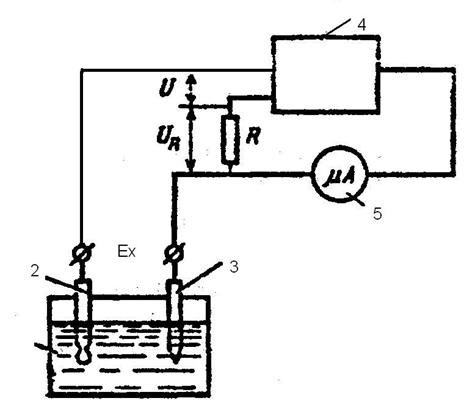
1 –сосуд с раствором
2 – измерительный электрод
3 – вспомогательный электрод
4 – усилитель
5 - микроамперметр
Рисунок 1 – Электроизмерительная схема рН-метра
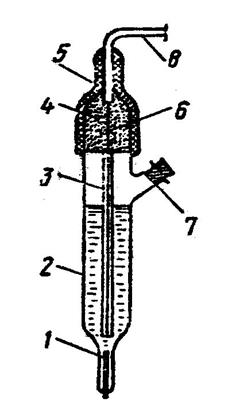
![]() 1 – асбестовая нить
1 – асбестовая нить
2 – сосуд с насыщенным раствором KCl
3 – асбестовый фильтр
4 – хлорид серебра
5 – пластмассовая крышка
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.