


3 src="https://files3.vunivere.ru/workbase/00/00/44/20/images/image001.gif" />
Министерство образования Российской Федерации
Санкт-Петербургский государственный горный институт им. Г.В. Плеханова
(технический университет)

(наименование учебной дисциплины согласно учебному плану)
Выполнил: студент гр. МЦ-03 ______________ /Луцкий Д С /
(подпись) (Ф.И.О.)
ОЦЕНКА: _____________
Дата: __________________
(подпись) (Ф.И.О.)
Санкт-Петербург
2005 год.
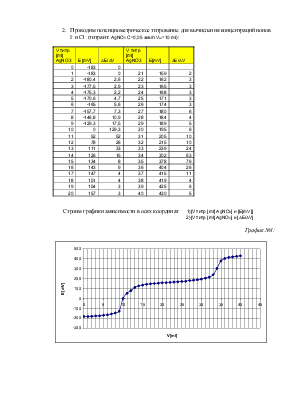
Цель работы: потенциометрическое титрование
Сущность работы: Определить Э.Д.С. элемента и потенциал металлического электрода в растворе соли. Коэффициент активности вычисляют по уравнению Нернста и сопоставляют со справочными данными.
Приборы: потенциометр
Бюретка
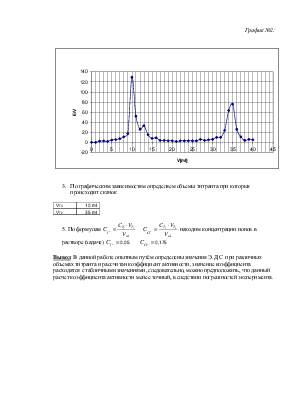
Пипетка V=10 ml
Стакан 200 ml
Серебряный электрод
Раствор AgNO3 0,05 H
Раствор КСl насыщенный
Задача
Ход работы:
В ходе измерений получаем следующие результаты:
|
C[CuSO4] = 0,5H |
E =99,6 mV |
|
C[CuSO4] = 0,05H |
E =81,3 mV |
Определение коэффициента активности для раствора 0,5 н.
1. ![]() вычисляем по
формуле
вычисляем по
формуле ![]() , где
, где ![]() ,
следовательно,
,
следовательно, ![]() .
.
2. Потенциал хлорсеребряного электрода находят по
формуле: ![]() , где t(0С) – температура, при
которой проводится опыт, в градусах Цельсия.
, где t(0С) – температура, при
которой проводится опыт, в градусах Цельсия. ![]() ,
тогда подставив ее в уравнение, получим:
,
тогда подставив ее в уравнение, получим: ![]() .
.
![]() , где
, где
![]() , выражая
активность
, выражая
активность ![]() , получим
, получим ![]() ,
,
3. ![]()
![]() (справочная
величина)
(справочная
величина)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.